12.(21分) 要求写出必要的文字说明、化学方程式和重要的解题步聚,只写出最后答案不给分。
著名的“侯氏制碱法”的第一步反应是向饱和食盐水中通入CO2而析出NaHCO3,该反应可表示为:NH3 + NaCl + CO2 + H2O = NaHCO3↓+ NH4Cl, 已知NaCl、NaHCO3、NH4Cl在不同温度的溶解度如下:
|
物质 |
NaCl |
NaHCO3 |
NH4Cl |
|
40℃时溶解度/g |
37 |
13 |
46 |
|
10℃时溶解度/g |
|
|
33 |
今在40℃时,向434 g饱和食盐水中通入44.8 L(标准状况)NH3,再向溶液中通入过量的CO2,
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
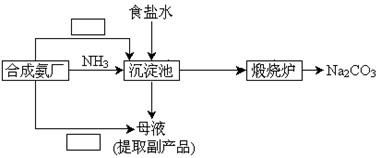
(5)某学生利用合成氨厂的原料和产物,设计了一个能充分利用各组成物质同时达到制取纯碱和回收氯化铵的实验方案。请你补充完整该学生的流程框图。
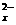 (X的数值在2~6之间)在碱性溶液中被BrO
(X的数值在2~6之间)在碱性溶液中被BrO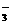 氧化为SO
氧化为SO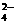 ,而BrO
,而BrO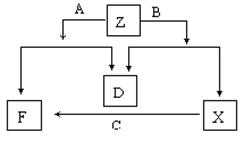
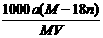 mol·L-1
mol·L-1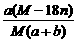 %
%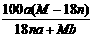 g
g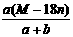 g·mL-1
g·mL-1