0.1℃,下同),记入表格;
②用另一个量筒量取50mL 0.55mol·L-1的NaOH溶
液,并用温度计测量氢氧化钠溶液的温度,记入表
格;
③在两个烧杯之间填满碎泡沫,并使杯口相平;盖板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过;
④把量筒中的氢氧化钠溶液倒入小烧杯中,并立即把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯中,用玻璃搅拌棒轻轻搅动溶液,准确读取混合溶液的温度,记入表格。
再重复实验两次,所得数据如下:
|
实验编号 |
起始温度t1/℃ |
终止温度 (t2/℃) |
温度差 (t2-t1)/℃ |
||
|
盐酸 |
氢氧化钠溶液 |
平均值 |
|||
|
1 |
20.0 |
20.0 |
20.0 |
23.4 |
3.4 |
|
2 |
20.0 |
20.0 |
20.0 |
23.4 |
3.4 |
|
3 |
20.0 |
20.0 |
20.0 |
21.6 |
1.6 |
回答下列问题:
(1)实验步骤的先后顺序为(填编号) 。
(2)步骤①、②中都使用了温度计,若使用同一支温度计,应注意的问题是
。
(3)试根据上述数据计算中和热[盐酸和氢氧化钠溶液的密度近似为1g/cm3,反应后溶液的比热容近似为4.18J/(g·℃)],并据此写出该反应的热化学方程式
。
(4)下列操作能够减少实验误差的是 (填代号)。
A.用保温杯代替烧杯
B.步骤②中的氢氧化钠溶液分多次倒入小烧杯中
C.步骤④中读取混合溶液的最高温度作为终止温度
D.其它数据不变,把50mL的盐酸和氢氧化钠溶液都改为5mL
E.其它数据不变,把盐酸和氢氧化钠溶液的浓度都增加10倍
(5)若将盐酸和氢氧化钠溶液分别改为醋酸和氨水,其它数据不变,则测得的中和热与上述实验测得的中和热比较 (填偏大、偏小或相同),原因是
。
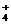 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO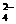 、NO
、NO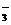 、OH-、CO
、OH-、CO 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验: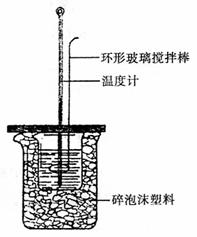 19.(11分)实验室用右图所示装置测定中和热。实验
19.(11分)实验室用右图所示装置测定中和热。实验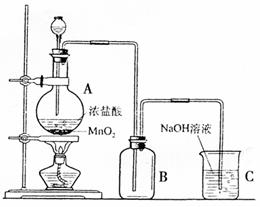 三、(本题包括2小题,共19分)
三、(本题包括2小题,共19分) cm-3的浓硫酸中加入一定量的水,稀释成
cm-3的浓硫酸中加入一定量的水,稀释成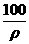 mL
mL