网址:http://m.1010jiajiao.com/timu3_id_341346[举报]
明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤如下:

回答下列问题:
(1) 明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为________________
(2) 沉淀物A中除含有Fe2O3外,还含有 ________、________。
(3) 操作①的名称为________、冷却结晶、过滤。
(4) 用14mol . L-1的浓氨水配制480 mL 2 mol . L‑1稀氨水:
①所用的容量瓶规格是________。
②稀释浓氨水用的烧杯和玻璃棒如何洗涤?________________________
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水:________。
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2〜3次,并将洗涤液转人容量瓶中: 。
(5) 确定钾氮复合肥中含有钾元素的方法 是 。
(6) 为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL。则钾氮复合肥中氮元素的质量分数为________ (用含m、V的代数式表示)。
查看习题详情和答案>>

①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑。
②CoCl2·6H2O熔点为86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表

(1)上述流程中过氧化氢的作用是________________。
(2)加入碳酸钠调节pH至a,a的范围是______________。
(3)操作I包含3个实验基本操作,它们依次是_______________和过滤。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是______________。
(5)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,除去不溶性杂质后,再进行___________操作。
(6)为测定产品中CoCl2·6H2O的含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液, 过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,请说出一条可能的原因_______________。
明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤如下:

回答下列问题:
(1) 明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为________________
(2) 沉淀物A中除含有Fe2O3外,还含有________、________。
(3) 操作①的名称为________、冷却结晶、过滤。
(4) 用14mol . L-1的浓氨水配制480 mL 2 mol . L‑1稀氨水:
①所用的容量瓶规格是________。②稀释浓氨水用的烧杯和玻璃棒如何洗涤?__________
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水:________。
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2〜3次,并将洗涤液转人容量瓶中: 。
(5) 确定钾氮复合肥中含有钾元素的方法是 。
(6) 为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL。则钾氮复合肥中氮元素的质量分数为________ (用含m、V的代数式表示)。
查看习题详情和答案>>医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2·2H2O的质量分数为97.3-103.0%),工艺流程为:

(1)CaCO3与
盐酸反应的离子方程式________.(2)
除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中少量的Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的实验操作是________.(3)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有________.滤渣主要成分的化学式________.
(4)酸化时加盐酸的目的为:①________,②防止Ca2+在蒸发时发生水解.
(5)为什么蒸发结晶要保持在160℃:________.
(6)为测定样品中CaCl2·2H2O的含量,称取0.75 g样品并配成250 mL溶液,各取该溶液25.00 mL,分别置于三个锥形瓶中,用0.04 mol/L AgNO3溶液进行三次滴定,消耗AgNO3溶液的平均体积为20.00 mL.
①通过计算,样品中含CaCl2·2H2O的质量分数为________.
②若所测样品CaCl2·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为________.
II.图B折线c可以表达出第
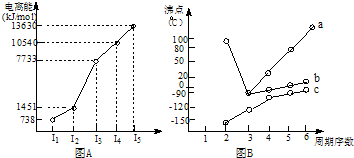
两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:
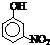
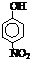
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 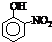 |
 |
 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
(2)COCl2俗称光气,分子中C原子采取
a.2个σ键 b.2个π键 c.1个σ键、1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为
II.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的
| 2 |
| 3 |