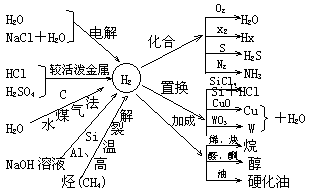
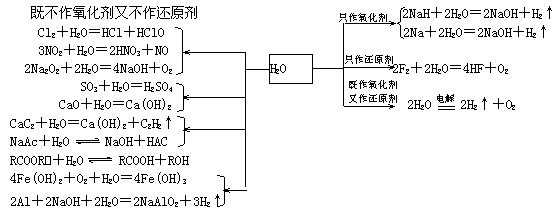
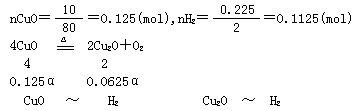0 33418 33426 33432 33436 33442 33444 33448 33454 33456 33462 33468 33472 33474 33478 33484 33486 33492 33496 33498 33502 33504 33508 33510 33512 33513 33514 33516 33517 33518 33520 33522 33526 33528 33532 33534 33538 33544 33546 33552 33556 33558 33562 33568 33574 33576 33582 33586 33588 33594 33598 33604 33612 447348

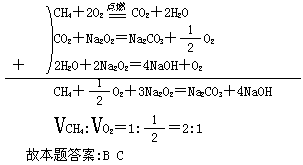
 2Cu2O+O2,
2Cu2O+O2,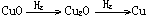 的顺序进行的,以x表示通入H2的质量(单位:g),试填写下表
的顺序进行的,以x表示通入H2的质量(单位:g),试填写下表