11、下列有关pH变化的判断中,正确的是
A.随着温度的升高,碳酸钠溶液的pH减小 B.随着温度的升高,纯水的pH增大
C.新氯水制经光照一段时间后,pH减小 D.氢氧化钠溶液久置于空气中,pH 增大
12、现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和
后,所得溶液的pH接近于
A a-lg2 B b-lg2 C a+lg2 D b+lg2
13、 0.1mol/L的NaOH溶液0.2L,通入448mL(S.T.P.)H2S气体,所得溶液离子浓度大小关系正确的是
A [Na+]>[HS-]>[OH-]>[H2S]>[S2-]>[H+]
增大
12、现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和
后,所得溶液的pH接近于
A a-lg2 B b-lg2 C a+lg2 D b+lg2
13、 0.1mol/L的NaOH溶液0.2L,通入448mL(S.T.P.)H2S气体,所得溶液离子浓度大小关系正确的是
A [Na+]>[HS-]>[OH-]>[H2S]>[S2-]>[H+]
B [Na+]+[H+]=[HS-]+[S2-]+[OH-] C [Na+]=[H2S]+[HS-]+[S2-]+[OH-]
D [S2-]+[OH-]=[H+]+[H2S]
14、在一定条件下发生下列反应,其中属于盐类水解反应的是
A.NH4++2H2O
 NH3·H2O+H3O+
B.HCO3-+ H2O
NH3·H2O+H3O+
B.HCO3-+ H2O  H3O+
+ CO32-
C.HS-+H+=== H2S D.Cl2+H2O
H3O+
+ CO32-
C.HS-+H+=== H2S D.Cl2+H2O
 H++Cl-+HClO
15、若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
H++Cl-+HClO
15、若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
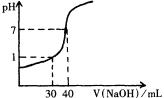 16、(4分) 右图为20mL未知浓度的盐酸用一标准浓度NaOH溶液滴定时的滴定曲线。则两种溶液的物质的量浓度分别是:
[HCl]=
,[NaOH]=
。
17、(8分)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该NaOH溶液中和,需VbLNaOH溶液。填空:
(1)若a + b = 14,则Va∶Vb= _____________(填数字)。
(2)若a + b = 13,则Va∶Vb= _____________(填数字)。
(3)若a + b >15,则Va∶Vb= _____(填表达式),且Va___Vb(填“>”“<”或“=”)
18、(5分)化学实验员给某学生提供下列药品和必要的实验仪器,要求学生设计实验,证明醛酸是弱酸。药品为冰醋酸、醋酸钠.蒸馏水和PH试纸。此同学思考后认为:
(1)设计的理论依据是_________________________;
(2)实验的简要步骤是__________________________;
(3)需记录的现象和数据是_____________________________;
(4)推断与分析:由于__________________,说明_____________,所以醋酸是弱酸。
19、(5分)实验室为测定一新配制的稀盐酸的准确浓度,通常是用纯净的Na2CO3(无水)配成标准溶液滴定。具体操作是:称取wg纯净的无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,从准确性考虑,滴定终点宜选在pH为4-5之间,那么指示剂宜选
,当滴定至溶液由 色变成 色时,即表示到达终点;
(2)若滴定到终点时,消耗盐酸的体积为VmL,则盐酸的物质的量浓度为____ mol/L。
20、(6分)有两份质量相同的氢氧化钠。第一份用煮沸后的蒸馏水配制后立即用盐酸滴定,所耗盐酸体积为V1;第二份用同样的蒸馏水配制放置一段时间后用上述盐酸滴定,盐酸耗去体积为V2。请问:
(1)若用甲基橙作指示剂,则V1和V2的关系为______________;
(2)若用酚酞作指示剂,则V1和V2的关系为_______________;
(3)若上述两种情况下配制的溶液体积相同,则氢氧化钠溶液浓度C1和C2的关系为____
_____________。
(注:用盐酸中和Na2CO3溶液时,分两个阶段进行反应:Na2CO3+HCl=NaCl+NaHCO3,此时溶液
16、(4分) 右图为20mL未知浓度的盐酸用一标准浓度NaOH溶液滴定时的滴定曲线。则两种溶液的物质的量浓度分别是:
[HCl]=
,[NaOH]=
。
17、(8分)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该NaOH溶液中和,需VbLNaOH溶液。填空:
(1)若a + b = 14,则Va∶Vb= _____________(填数字)。
(2)若a + b = 13,则Va∶Vb= _____________(填数字)。
(3)若a + b >15,则Va∶Vb= _____(填表达式),且Va___Vb(填“>”“<”或“=”)
18、(5分)化学实验员给某学生提供下列药品和必要的实验仪器,要求学生设计实验,证明醛酸是弱酸。药品为冰醋酸、醋酸钠.蒸馏水和PH试纸。此同学思考后认为:
(1)设计的理论依据是_________________________;
(2)实验的简要步骤是__________________________;
(3)需记录的现象和数据是_____________________________;
(4)推断与分析:由于__________________,说明_____________,所以醋酸是弱酸。
19、(5分)实验室为测定一新配制的稀盐酸的准确浓度,通常是用纯净的Na2CO3(无水)配成标准溶液滴定。具体操作是:称取wg纯净的无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,从准确性考虑,滴定终点宜选在pH为4-5之间,那么指示剂宜选
,当滴定至溶液由 色变成 色时,即表示到达终点;
(2)若滴定到终点时,消耗盐酸的体积为VmL,则盐酸的物质的量浓度为____ mol/L。
20、(6分)有两份质量相同的氢氧化钠。第一份用煮沸后的蒸馏水配制后立即用盐酸滴定,所耗盐酸体积为V1;第二份用同样的蒸馏水配制放置一段时间后用上述盐酸滴定,盐酸耗去体积为V2。请问:
(1)若用甲基橙作指示剂,则V1和V2的关系为______________;
(2)若用酚酞作指示剂,则V1和V2的关系为_______________;
(3)若上述两种情况下配制的溶液体积相同,则氢氧化钠溶液浓度C1和C2的关系为____
_____________。
(注:用盐酸中和Na2CO3溶液时,分两个阶段进行反应:Na2CO3+HCl=NaCl+NaHCO3,此时溶液 pH=8.4,NaHCO3+HCl=NaCl+H2O+CO2↑,若CO2未赶掉,则溶液的pH约为3.9)
21、(4分)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=
。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb=
。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb=
。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb=
。
22、(5分)中和滴定过程中,下列操作能否使测定结果(待测液的浓度数值)发生偏差,请将差别情况的编号写出。
pH=8.4,NaHCO3+HCl=NaCl+H2O+CO2↑,若CO2未赶掉,则溶液的pH约为3.9)
21、(4分)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=
。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb=
。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb=
。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb=
。
22、(5分)中和滴定过程中,下列操作能否使测定结果(待测液的浓度数值)发生偏差,请将差别情况的编号写出。
|
(1)滴定管用蒸馏水润洗后立即用于中和滴定 |
( ) |
|
(2)锥形瓶用蒸馏水润洗后立即盛装待测液 |
( ) |
|
(3)滴定完毕,尖嘴外留有液滴 |
( ) |
|
(4)滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失 |
( ) |
|
(5)滴定前仰视读数而滴定终了俯视读数 |
( ) |
A 偏高 B偏低
C 无影响
23、(6分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,醋酸铵溶液呈中性。现向少量的Mg(OH)2悬浊液中,加入适量的值和氯化铵溶液,固体完全溶解。甲同学的解释是:
Mg(OH)2(固) 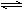 Mg2++2OH―-----------------------------------------①
NH4++H2O
Mg2++2OH―-----------------------------------------①
NH4++H2O 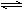 NH3·H2O+H+------------------------------------------②
H++OH-
NH3·H2O+H+------------------------------------------②
H++OH- 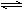 H2O…………………③
由于NH4+水解显酸性:H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:Mg(OH)2(固)
H2O…………………③
由于NH4+水解显酸性:H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:Mg(OH)2(固)  Mg2++2OH―…………①
NH4++OH-
Mg2++2OH―…………①
NH4++OH-  NH3·H2O…………………②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH‑结合,生成了弱的电解质NH3·H2O导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由
。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理
(填“甲’’或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式
24、(8分)为测定人呼出的气体中的二氧化碳的含量,将1000 mL(已按标准状况折算)呼出的气体通入50.0 mL氢氧化钡溶液中,使其完全吸收,过滤后取20.0 mL澄清溶液,用0.100 mol·L-1盐酸滴定,当消耗20.4mL盐酸时恰好完全反应。另取20.0 mL原氢氧化钡溶液,用同种盐酸滴定,耗去36.4 mL盐酸时,恰好反应完全。试求人呼出气体中CO2的体积分数。
NH3·H2O…………………②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH‑结合,生成了弱的电解质NH3·H2O导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由
。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理
(填“甲’’或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式
24、(8分)为测定人呼出的气体中的二氧化碳的含量,将1000 mL(已按标准状况折算)呼出的气体通入50.0 mL氢氧化钡溶液中,使其完全吸收,过滤后取20.0 mL澄清溶液,用0.100 mol·L-1盐酸滴定,当消耗20.4mL盐酸时恰好完全反应。另取20.0 mL原氢氧化钡溶液,用同种盐酸滴定,耗去36.4 mL盐酸时,恰好反应完全。试求人呼出气体中CO2的体积分数。
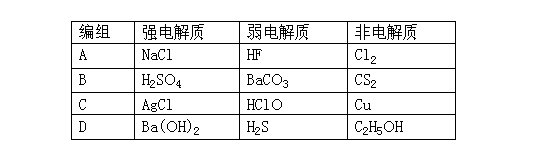
7D
例8. 某有机物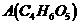 广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。该化合物具有如下性质:①在25℃时,电离常数
广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。该化合物具有如下性质:①在25℃时,电离常数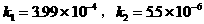 ;②
;② (或
(或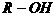 )
) 有香味产物;③
有香味产物;③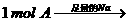 慢慢产生1.5 mol气体;④A在一定温度下的脱水产物(不是环状化合物)可和溴水发生加成反应。试回答:
慢慢产生1.5 mol气体;④A在一定温度下的脱水产物(不是环状化合物)可和溴水发生加成反应。试回答:
(1)根据以上信息,对A的结构作出的判断是_______________。
A. 肯定有碳碳双键
B. 有两个羧基
C. 肯定有羟基
D. 有 官能团
官能团
(2)有机物A的结构式(不含 )为_____________。
)为_____________。
(3)A脱水产物和溴水反应的化学方程式______________。
(4)A的一个同类别的同分异构体是__________________。
解析:(1)根据信息①可知,A分子中有2个 ;由信息②可知,A分子中有醇羟基;由信息③可得,
;由信息②可知,A分子中有醇羟基;由信息③可得,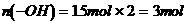 。故A分子中有2个
。故A分子中有2个 ,1个
,1个 ,选B、C。
,选B、C。
(2)采用残基法可得: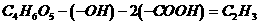 ,又已知A中不含
,又已知A中不含 ,则可看作是乙烷分子中的3个H被1个
,则可看作是乙烷分子中的3个H被1个 、2个
、2个 取代,即有:
取代,即有:
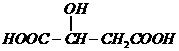
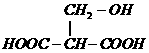
(3)根据信息④和上述(2)的结论可知,A脱水可生成两种产物: 或
或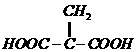 ,故与溴水反应的化学方程式为:
,故与溴水反应的化学方程式为: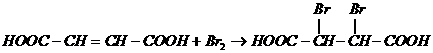 或
或
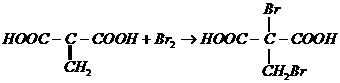
(4)利用上述(2)的结论可知,A属羟基酸,故与A同类别的同分异构体是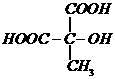
|
年级 |
高中 |
学科 |
化学 |
版本 |
|
期数 |
|
||||||
|
内容标题 |
多官能团有机物试题分类例析 |
||||||||||||
|
分类索引号 |
G.622.46 |
分类索引描述 |
辅导与自学 |
||||||||||
|
主题词 |
多官能团有机物试题分类例析 |
栏目名称 |
专题辅导 |
||||||||||
|
供稿老师 |
|
审稿老师 |
|
||||||||||
|
录入 |
李红英 |
一校 |
康纪云 |
二校 |
|
审核 |
|
||||||
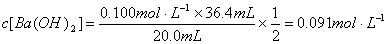 (2分)
吸收CO2后Ba(OH)2的浓度:
(2分)
吸收CO2后Ba(OH)2的浓度:
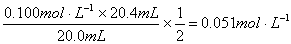 (2分)
n(CO2)= n(BaCO3)=(0.091 mol·L-1-0.051 mol·L-1)×50×10-3 L=0.002mol (2分)
(2分)
n(CO2)= n(BaCO3)=(0.091 mol·L-1-0.051 mol·L-1)×50×10-3 L=0.002mol (2分)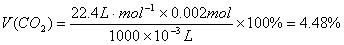 (2分)
(2分) ,则下列叙述正确的是
A.中性溶液的AG=0
B.酸性溶液的AG<0
C.常温下0.lmol/L氢氧化钠溶液的AG=12 D.常温下0.lmol/L盐酸溶液的AG>12
6、物质的量浓度相同的下列溶液中,含微粒种类最多的是
A.CaCl2
B.CH3COONa C.NH3 D.K2S
7、下列实验过程中产生的现象与对应的图形相符合的是
,则下列叙述正确的是
A.中性溶液的AG=0
B.酸性溶液的AG<0
C.常温下0.lmol/L氢氧化钠溶液的AG=12 D.常温下0.lmol/L盐酸溶液的AG>12
6、物质的量浓度相同的下列溶液中,含微粒种类最多的是
A.CaCl2
B.CH3COONa C.NH3 D.K2S
7、下列实验过程中产生的现象与对应的图形相符合的是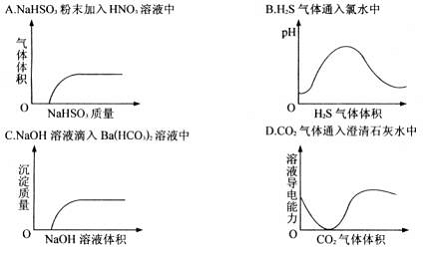 8、相同条件下,等体积、等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
9、将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A.溶液的pH增加
B.CH3COOH电离的百分率变大
C.溶液的导电能力减弱
D.溶液中[OH-]减小
10、如图为10mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是
8、相同条件下,等体积、等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
9、将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A.溶液的pH增加
B.CH3COOH电离的百分率变大
C.溶液的导电能力减弱
D.溶液中[OH-]减小
10、如图为10mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是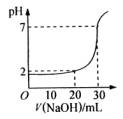
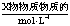
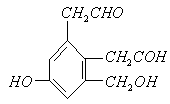
 反应的有酚羟基和羧基,与新制的
反应的有酚羟基和羧基,与新制的 反应的有醛基和羧基。根据官能团的数目可确定各自的量。但必须注意的是醛基的氧化产物是羧基,也会与
反应的有醛基和羧基。根据官能团的数目可确定各自的量。但必须注意的是醛基的氧化产物是羧基,也会与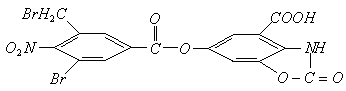
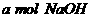 ,将所得溶液蒸干后,再与足量的碱石灰共热,又消耗b mol
,将所得溶液蒸干后,再与足量的碱石灰共热,又消耗b mol 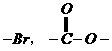 和
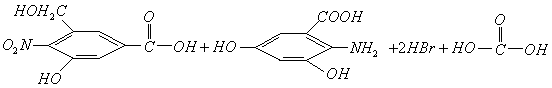
和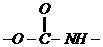 在碱性条件下发生水解反应,其反应方程式为:
在碱性条件下发生水解反应,其反应方程式为: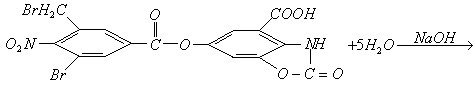
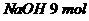 。
。 ,加热时可与2 mol
,加热时可与2 mol 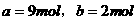 。
。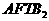 )是污染粮食的真菌霉素,有致癌性。跟 1 mol该化合物起反应的H2和NaOH的最大量分别为( )
)是污染粮食的真菌霉素,有致癌性。跟 1 mol该化合物起反应的H2和NaOH的最大量分别为( )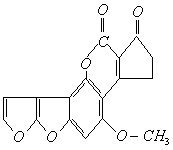
 、苯环和羰基。与
、苯环和羰基。与