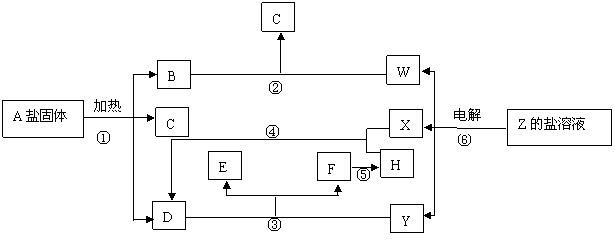
20、(9分)纯碱是一种重要的化工原料,很多工业都需要用到纯碱。
|
的缺点是__________________。第二步中反应为:①Na2SO4+2C ==== Na2S+2CO2↑、
|
②Na2S+CaCO3 ======Na2CO3+CaS,其中属于氧化还原反应的为 _______________,该反应中氧化剂为_______________。


(提取副产品)
(2)19世纪中叶比利索尔维发明了氨碱法制纯碱,但存在原料利用率不高和副产品多的缺点。我国化学家侯德榜(如图)改革了此生产工艺,生产流程简要表示如上:
上述生产流程中原料氯化钠的利用率从70%提高到90%以上,主要是设计了_______________(填上述流程中的编号)的循环。上述流程中X物质的分子式为_______________。写出沉淀中发生的化学反应方程式_______________,从沉淀池中取出沉淀的操作是_______________
(3)在实验室可以利用Na2CO3溶液通过一步反应可获得NaOH,请写出该反应的化学方程式_______________
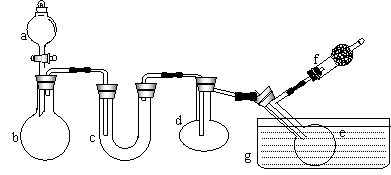
18、(9分)已知三氯化磷和五氯化磷的有关物理量如下表。某学生拟用下图所示装置(酒精灯、铁架台等未画出)制取三氯化磷。实验时,在蒸馏烧瓶d中放入足量白磷,将氯气迅速而又不间断地通入蒸馏烧瓶d 中,氯气与白磷发生反应,并产生火焰。请回答下列问题:
|
|
熔点 |
 沸点 沸点 |
|
三氯化磷 |
-112℃ |
76℃ |
|
五氯化磷 |
148℃ |
200℃分解 |
(1)有浓盐酸、浓硫酸、白磷、二氧化锰、氢氧化钠等物质供选用,a,b中应该装入的试剂分别是:
a、_____________b、_______________
(2)实验中需要加热的仪器有(填仪器对应的字母)________________________
(3)生成的三氯化磷在蒸馏烧瓶e中收集,为保证三氯化磷蒸气完全冷凝,在水槽g中应加入:_______
(4)三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d、e仪器及盛放其中的物质都应是干燥的。为除去氯气中的水分并防止外界的水分进入 装置,c中应装入下列物质中的(填字母,下同)_____,F中应装入下列物质中的 ____________
A、碱石灰 B、浓硫酸 C、无水氯化钙
(5)氯气和白磷反应放出大量的热,为使蒸馏烧瓶d不致因局部过热而炸裂,实验开始前应在蒸馏烧瓶d的底部入放少量:______________
(6)蒸馏烧杯e中收集到的三氯化磷中常含有少量的五氯化磷,请设计实验将三氯化磷与五氯化磷分离:______________________