21、图表法、图象法是常用的科学研究方法。
(Ⅰ)电离能是指由蒸气状态的孤立原子失去电子形成阳离子需要的能量。从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依次类推。
现有5种元素L、M、N、O、P,其I1-I3分别如下表,根据表中数据判断其中的金属元素有 ,稀有气体元素是 ,最活泼的金属是 ,显二价的金属是 。
|
元 素 |
I1/eV |
I2/eV |
I3/eV |
|
L |
13.0 |
23.9 |
40.0 |
|
M |
4.3 |
31.9 |
47.8 |
|
N |
5.7 |
47.4 |
71.8 |
|
O |
7.7 |
15.1 |
80.3 |
|
P |
21.6 |
41.1 |
65.2 |
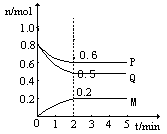
(Ⅱ)某温度时,在一个5L的密闭容器中,M、P、Q三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)若M、P、Q均为气体,反应达平衡时:
①体系的压强是开始时的 倍;从反应开始到平衡气体M的平均反应速率为
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等)。
(3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是 。
17、根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
|
元素代号 |
K |
L |
M |
N |
P |
|
原子半径/nm |
0.136 |
0.118 |
0.089 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的水溶液酸性强弱为H2P > H2N B.L与P形成的化合物具有两性
C.单质与稀盐酸反应的速率为K<M D.K2+与N2-的核外电子数相等
 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。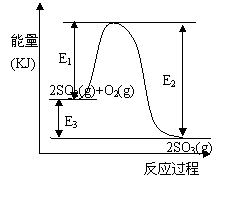

 E3 (填“增大”“减小”或“不变”)。
E3 (填“增大”“减小”或“不变”)。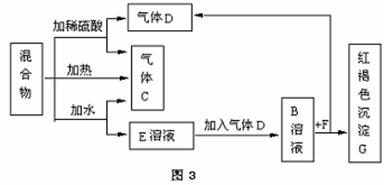 由A、B两种常见化合物按物质的量之比为1∶2组成混合物,其相互关系如图。已知A、B的焰色反应均呈黄色,
由A、B两种常见化合物按物质的量之比为1∶2组成混合物,其相互关系如图。已知A、B的焰色反应均呈黄色,



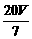 g
g