13.(2010年淄博质检)某化学课外小组欲用固体与液体反应(不需加热),快速简便地制取一满瓶(125 mL)干燥的氧气。
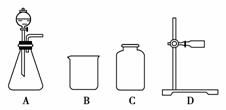
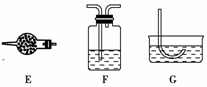
(1)从所提供的仪器(或装置)A至G中,选出所需要的(填序号)________。
(2)选用的试剂为______________________,化学反应方程式为_____________________ ______________________________________________________________________________。
(3)用上述所选的气体发生装置,除可制取O2、H2、CO2外,请于下表中写出还可用此装置制取的2种其他气体及制取该气体所需的试剂。
|
|
气体 |
所需试剂 |
|
① |
|
|
|
② |
|
|
[解析] 可利用Na2O2和H2O反应制取O2,可用碱石灰或浓H2SO4干燥O2。
[答案] (1)AE(或F)C
(2)Na2O2、H2O、碱石灰(或浓H2SO4) 2Na2O2+2H2O===4NaOH+O2↑(其他答案,合理即可)
(3)
|
|
气体 |
所需试剂 |
|
① |
NH3 |
浓氨水、生石灰 |
|
② |
SO2 |
Na2SO3、浓硫酸 |
 2H2O
2H2O Cl2
Cl2

 8NH3+3Cl2===6NH4Cl+N2,大量白烟是生成NH4Cl的缘故。每2
mol NH3被氧化
8NH3+3Cl2===6NH4Cl+N2,大量白烟是生成NH4Cl的缘故。每2
mol NH3被氧化