9.(1)一定条件下的可逆反应:mA(g) + nB(g)  pC(g)
+ qD(g)的化学平衡常数K可表示为:
pC(g)
+ qD(g)的化学平衡常数K可表示为: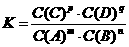 ,则K值越大,表示可逆反应的进行程度______________,K值大小与温度的关系是:温度越高,K值_________(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
,则K值越大,表示可逆反应的进行程度______________,K值大小与温度的关系是:温度越高,K值_________(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+ H2O(g)
 CO2(g)
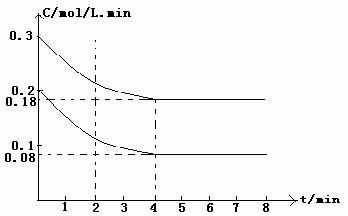
+ H2(g); △H<0, CO和H2O浓度变化如下图,则0-4 min的平均反应速率v(CO)=_____________mol/L·min.
CO2(g)
+ H2(g); △H<0, CO和H2O浓度变化如下图,则0-4 min的平均反应速率v(CO)=_____________mol/L·min.
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器中各物质的浓度如右表:
|
t/min |
C(CO) |
C(H2O) |
C(CO2) |
C(H2) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
C1 |
C2 |
C3 |
C3 |
|
4 |
C1 |
C2 |
C3 |
C3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
1表中3-4 min之间反应处于___________状态;C1数值______0.08mol/L(填大于、小于或等于)。
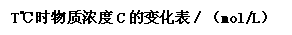 2反应在4-5min之间,平衡向逆方向移动,可能的原因是______________,表中5-6min之间数值发生变化,可能的原因是_________。(均为单选)
2反应在4-5min之间,平衡向逆方向移动,可能的原因是______________,表中5-6min之间数值发生变化,可能的原因是_________。(均为单选)
A 增加水蒸气
B 降低温度
C 使用催化剂 D增加氢气浓度
[解析]:本题主要考查一定条件下的可逆反应,在外界条件发生变化时,化学平衡的移动、化学反应速率的计算等知识。
(1)越大;可能增大也可能减小。(每空2分)
(2)0.03(2分)
(3)1平衡;>. 2D; A.(每空2分)
8.氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等,为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
(1)制备氧化铜:
|


1步骤I的目的是除去不溶性杂质,操作是_______________________________。
2步骤II的目的是除铁,操作是滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液 pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液 pH=3.5的原因是______________________
__________________________________。
3步骤III的目的是得到CuSO4·5H2O晶体,操作是________________________,过滤,水浴加热烘干,水浴加热的特点是__________________________________。
(2)探究氧化铜的性质:
1取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积、质量分数为30%的H2O2溶液,只观察到A中的大量的气泡。结论是________
_____________________________________________________。
2为探究试管A中的反应速率,收集气体并测定其体积,必须的实验仪器有
______________________________________________________。
[解析]:本题主要考查物质的制法、化学实验的基本操作、仪器的使用、性质的运用等。
(1)1加适量的水溶解,搅拌、过滤。(3分)2使Fe3+全部转化为Fe(OH)3沉淀,而Cu2+不会转化为Cu(OH)2沉淀。(2分)3将CuSO4溶液加热至开始出现晶体时,停止加热;(2分)恒温且受热均匀,温度易于控制在100℃以下。(2分)
(2)1CuO可加快H2O2的分解的反应速率,是H2O2分解反应的催化剂。(3分)
2秒表、橡皮塞、导管、集气瓶、量筒。(3分)
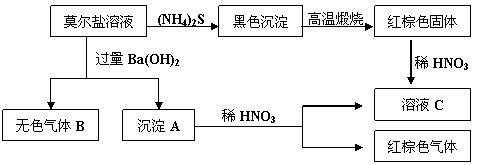 莫尔盐是硫酸盐的一种复盐,它是一种重要的化学试剂,有如下反应:
莫尔盐是硫酸盐的一种复盐,它是一种重要的化学试剂,有如下反应: