6.(2010年江苏高考)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下

 w_w w. k#s5_
w_w w. k#s5_
(已知
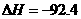 kJ·mol
kJ·mol ):
):
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的浓度(mol·L ) ) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
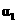 |
 |
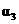 |
下列说法正确的是
A.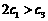 B.
B.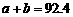 C.
C. D.
D.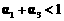
解析:本题主要考查的是化学平衡和反应热的有关知识。在等温等容时,若起始物质的量不同,则转化率也不同,也不成倍数关系,应该是2 c1<c3,A错误;B项,实际上为等效平衡,不同的是反应的起始方向不同,因此过程中乙吸收的热热量相当于过程甲甲完全转化需再放出的热量,故a+b=92.4,B正确;C项,根据平衡的建立过程,通过模拟中间状态分析,丙的转化率小于乙,故2p2>p3,C错误;因为甲、乙两过程属于等效平衡,所以a1+a2=1,而a2> a3,所以a1+ a3<1.综上分析可知,本题选BD项。
答案:BD

 w_w w. k#s5_
w_w w. k#s5_
 CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)  (W)=3
(W)=3 的平衡常数
的平衡常数 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是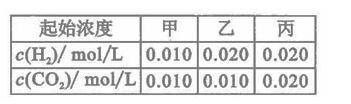
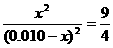 ,解得x=0.006,所以H2、CO2的转化率均为60%,此时CO2的浓度是0.004。反应前后体积不变,因此甲和丙中的平衡等效,B正确;由于容器的容积相同,所以平衡时,丙中c(CO2)是甲中的2倍,是0.008mol/L,C错;乙可以看作是在甲的基础上增大氢气的物质的量浓度,所以可以提高CO2的转化率,A正确;浓度越高,压强越大,反应越快,D正确;
,解得x=0.006,所以H2、CO2的转化率均为60%,此时CO2的浓度是0.004。反应前后体积不变,因此甲和丙中的平衡等效,B正确;由于容器的容积相同,所以平衡时,丙中c(CO2)是甲中的2倍,是0.008mol/L,C错;乙可以看作是在甲的基础上增大氢气的物质的量浓度,所以可以提高CO2的转化率,A正确;浓度越高,压强越大,反应越快,D正确; 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是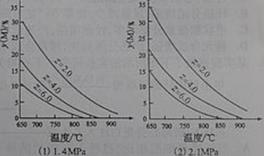 (2010年四川)反应aM(g)+bN(g)
(2010年四川)反应aM(g)+bN(g)  cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是 (2010年福建)化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如右图所示,计算反应4-8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是
(2010年福建)化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如右图所示,计算反应4-8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是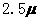 mol·L-1·min-1和
mol·L-1·min-1和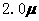 mol·L-1
mol·L-1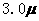 mol·L-1·min-1和
mol·L-1·min-1和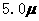 mol·L-1·min-1和
mol·L-1·min-1和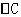 为
为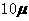 mol·L-1·min-1,△t为4分,所以在4-8min间的平均反应速率为
mol·L-1·min-1,△t为4分,所以在4-8min间的平均反应速率为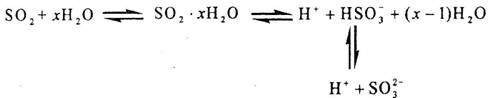
 2N2(g) + 3H2O(g) ΔH<0
2N2(g) + 3H2O(g) ΔH<0 
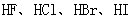 酸性递增的事实,推出
酸性递增的事实,推出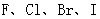 的非金属性递增的规律
的非金属性递增的规律