[例4] 图4-1是石英晶体平面示意图,它实际上是立体的网状结构,其中硅、氧原子数之比为_______。原硅酸根离子SiO44-的结构如图4-2所示,二聚硅酸根离子Si2O76-中,只有硅氧键,它的结构可表示为_______。
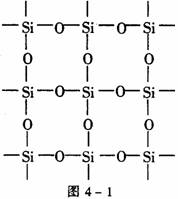
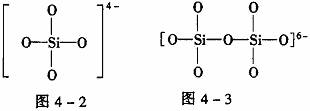
[解析] 由图4-1可以看出:每个硅原子周围结合4个氧原子,同时每个氧原子跟2个硅原子结合,因此二氧化硅晶体(石英)是由氧、硅原子按原子个数1∶2组成的立体空间网状结构的原子晶体。Si2O76-只有硅氧键,根据SiO44-的结构图可得Si2O76-的结构图见图4-3。
[例5] (1)中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图4-4所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
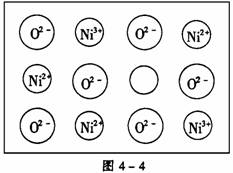
[解析] 晶胞中阴、阳离子个数的确定通常采用“原子分割法”,具体如下:①处于顶点的离子,同时为8个晶胞共有,每个离子有1/8属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有1/4属于晶胞;③处于面上的离子,同时为2个晶胞共有,每个离子有1/2属于晶胞;④处于内部的1个离子,则完全属于该晶胞,该离子数目为1。要确定NiO的密度,就应确定单位体积中NiO分子的个数,再结合NiO的摩尔质量求算出该晶体中NiO的质量,最后求出密度。本题解答如下:
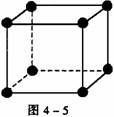
(1)如图4-5所示,以立方体作为计算单元,此结构中含有Ni2+-O2-离子数为:4×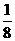 =
=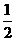 (个),所以1 mol NiO晶体中应含有此结构的数目为6.02×1023÷
(个),所以1 mol NiO晶体中应含有此结构的数目为6.02×1023÷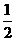 =12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1 mol NiO的体积应为12.04×1023×(a×10-8)cm3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为
=12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1 mol NiO的体积应为12.04×1023×(a×10-8)cm3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为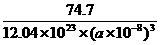 =
=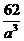 (g/cm3)
(g/cm3)
(2)解法一(列方程):设1 mol Ni0.97O中含Ni3+为 x mol,Ni2+为y mol,则得

解得x=0.06,y=0.91,故n(Ni3+)∶n(Ni2+)=6∶91
解法二(十字交叉):由化学式Ni0.97O求出Ni的平均化合价为2/0.97,则有
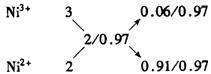
故n(Ni3+)∶n(Ni2+)=6∶91。
基础知识
1.化学键
 化 定义 化 定义学 键 类型 |
相邻的原子之间强烈的相互作用 离子键 共价键 |
|
|
概念 |
间通过 形成的化学键 |
间通过
(电子云重叠)所形成的化学键 |
|
成键微粒 |
|
|
|
作用方式 |
|
|
|
实例 |
CaCl2、Na2O2、NaOH、NaH |
Cl2、CCl4、H2O、HF、HNO3 |
|
用电子式表示形成过程 |
MgCl2: |
N2: CO2: |
1.分类
表4-6各种晶体类型的比较
|
|
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
存在微粒 |
阴阳离子 |
原子 |
分子 |
金属离子、自由电子 |
|
微粒间作用 |
离子键 |
共价键 |
范德华力 |
金属键 |
|
主要性质 |
硬而脆,易溶于极性溶剂,熔化时能够导电,溶沸点高 |
质地硬,不溶于大多数溶剂,导电性差,熔沸点很高 |
硬度小,水溶液能够导电,溶沸点低 |
金属光泽,是电和热的良导体,熔沸点高或低 |
|
实例 |
食盐晶体 |
金刚石 |
氨、氯化氢 |
镁、铝 |
2.常见分子的类型与形状
表4-5常见分子的类型与形状比较
|
分子类型 |
分子形状 |
键角 |
键的极性 |
分子极性 |
代表物 |
|
A |
球形 |
|
|
非极性 |
He、Ne |
|
A2 |
直线形 |
|
非极性 |
非极性 |
H2、O2 |
|
AB |
直线形 |
|
极性 |
极性 |
HCl、NO |
|
ABA |
直线形 |
180° |
极性 |
非极性 |
CO2、CS2 |
|
ABA |
角形 |
≠180° |
极性 |
极性 |
H2O、SO2 |
|
A4 |
正四面体形 |
60° |
非极性 |
非极性 |
P4 |
|
AB3 |
平面三角形 |
120° |
极性 |
非极性 |
BF3、SO3 |
|
AB3 |
三角锥形 |
≠120° |
极性 |
极性 |
NH3、NCl3 |
|
AB4 |
正四面体形 |
109°28′ |
极性 |
非极性 |
CH4、CCl4 |
|
AB3C |
四面体形 |
≠109°28′ |
极性 |
极性 |
CH3Cl、CHCl3 |
|
AB2C2 |
四面体形 |
≠109°28′ |
极性 |
极性 |
CH2Cl2 |
1.非极性分子和极性分子
表4-4 非极性分子和极性分子的比较
|
|
非极性分子 |
极性分子 |
|
形成原因 |
整个分子的电荷分布均匀,对称 |
整个分子的电荷分布不均匀、不对称 |
|
存在的共价键 |
非极性键或极性键 |
极性键 |
|
分子内原子排列 |
对称 |
不对称 |
表4-3非极性键和极性键的比较
|
|
非极性键 |
极性键 |
|
概念 |
同种元素原子形成的共价键 |
不同种元素原子形成的共价键,共用电子对发生偏移 |
|
原子吸引电子能力 |
相同 |
不同 |
|
共用电子对 |
不偏向任何一方 |
偏向吸引电子能力强的原子 |
|
成键原子电性 |
电中性 |
显电性 |
|
形成条件 |
由同种非金属元素组成 |
由不同种非金属元素组成 |
 是对称的平面结构,所以是非极性分子
是对称的平面结构,所以是非极性分子