2、 2005年是勒夏特列诞生155周年,他于1888年发现的“勒夏特列原理”,将指导我们正确地判断平衡移动的方向。现有Fe3+和I一在水溶液中如下反应:2I-+2Fe3+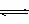 2Fe2++I2(aq)。
2Fe2++I2(aq)。
(1)当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡 移动(填“向右”“向左”或“不”)。
(2)上述反应的正向反应速率和I一、Fe3+的浓度关系为:v=Kc(I一)mc(Fe3+)n(K为常数)。
|
|
c(I一)/mol·L一1 |
c(Fe3+)/mol·L一1 |
v/mol·L-1·S-1 |
|
① |
0.20 |
O.80 |
O.032K |
|
② |
O.60 |
O.40 |
O.144K |
|
③ |
0.80 |
O.20 |
O.128K |
通过所给的数据计算得知:
在V=Kc(I一)mc(Fe3+)n中,m、n的值为 。
A.m=1,n=1 B.m=1,n=2 C.m=2,n=l D.m=2,n=2
(3)I一浓度对反应速率的影响 Fe3+浓度对反应速率的影响。(填“小于”“大于”或“等于”)
[答案](1)向右 (2)C(3)大于
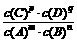 ,当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中就不写固体浓度,如CaCOa(s)
,当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中就不写固体浓度,如CaCOa(s) 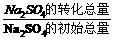 ×100%,
×100%,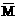 (g)]、气体的总质量(∑m(g)]的变化,描述正确的图像是 。
(g)]、气体的总质量(∑m(g)]的变化,描述正确的图像是 。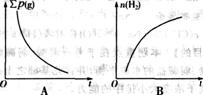
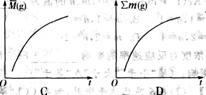
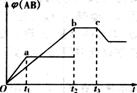 例1 反应A2+B2
例1 反应A2+B2 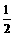 A2(g)+
A2(g)+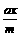 ×100%
×100%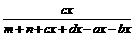 ×100%
×100%