摘要:6.对时间-速率图像.要注意分清曲线的连续性.跳跃性.是“渐变 还是“突变 .是“变大 还是“变小 .变化后是否仍然相等等情况.才可以确定对应改变的条件及如何改变. 典型例题 例1 反应A2+B2 2AB,ΔH=Q kJ·mol-1在不同温度和压强改变条件下.产物AB的生成情况如右图所示:a为500℃.b为300℃时情况.c为300℃时从时间t3开始向容器中加压的情况. (1)下列叙述正确的是 . A.A2.B2.AB均为气体.Q>O B.AB为气体.A2.B2中至少有一种为非气体.Q>O C.AB为气体.A2.B2中至少有一种为非气体.Q<O D.AB为固体.A2.B2中至少有一种为非气体.Q<O (2)已知Q的绝对值为200.则该反应的热化学方程式正确的是 . A.A2(g)+B2(s) 2AB(g),ΔH=200 kJ·mol-1 B.A2(l)+B2(g) 2AB(g),ΔH=一200 kJ·mol-1 C.A2+B2 2AB,ΔH=一200 kJ·mol-1 D.A2(g)+B2(s) AB(g),△H=一100kJ·mol-1 (3)在500℃时.在一容积固定的密闭容器中建立了上述[(2)中所选择的热化学方程式]平衡.若保持温度不变.再向容器中分别加了A2或B2或AB时.判断平衡的移动情况(填“正向 “逆向 或“不 )以及当容器中AB的体积分数不再变化时.与原平衡时比较(填“增大 减小 或“不变 ). ①加A2:平衡 移动.φ(AB) , ②加B2:平衡 移动.φ(AB) , ③加AB:平衡 移动.φ(AB) . [答案]①正向 减小②不不变③逆向 减小
网址:http://m.1010jiajiao.com/timu3_id_60667[举报]
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响。
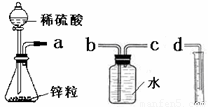
(1)为达到本实验目的其装置连接顺序为:a连________,________连________.
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
|
加入的试剂 |
H2的体积(相同条件下) |
反应时间 |
反应速率 |
|
1mol/L硫酸酸 |
10mL |
t1 |
v1 |
|
4mol/L硫酸 |
10mL |
t2 |
v2 |
该小组同学通过实验得到的结果是:v1 小于 v2,其定量依据是_______________________.
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:

请在给定的坐标图中作出v(H2)-t的图像.
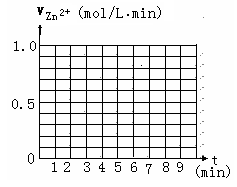
请解释0到4mim时该化学反应速率随时间变化的原因: .
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有: (任写一种).
查看习题详情和答案>>
Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是
(2)要加快上述实验中气体产生的速率,还可采取的措施有
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
请完成此实验设计,其中:V2
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2?
(5)分析乙组实验数据,HA是
(6)丙组所得混合液中由水电离出的c(OH-)=
查看习题详情和答案>>
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是
硫酸铜与Zn反应产生的Cu与Zn及电解质溶液构成原电池,加快反应速率
硫酸铜与Zn反应产生的Cu与Zn及电解质溶液构成原电池,加快反应速率
;(2)要加快上述实验中气体产生的速率,还可采取的措施有
升高温度、增大锌粒接触面积
升高温度、增大锌粒接触面积
(答两种);(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实 验 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | 15 | 10 | 0 |
=
=
V5=30
30
,V6=10
10
,V8=19.5
19.5
;(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
| 组别 | c(HA)/mol?L-1 | c(NaOH)/mol?L-1 | 混合液pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
(4)仅从甲组情况分析,c是否一定等于0.2?
否
否
(选填“是”或“否”).(5)分析乙组实验数据,HA是
弱
弱
酸(选填“强”或“弱”).该混合液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
c(Na+)>c(A-)>c(OH-)>c(H+)
.(6)丙组所得混合液中由水电离出的c(OH-)=
10-5
10-5
mol?L-1.某同学在用稀盐酸与铁制取氢气的实验中,发现加入少量氯化铜溶液可加快氢气的生成速率.请回答下列问题:
(1)要加快上述实验中气体产生的速率,还可采取的措施有
(2)实验室中现有NaCl、CuSO4、FeCl2、ZnCl2等4种溶液,可与实验中CuCl2溶液起相似作用的是
(3)为了进一步研究氯化铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=
②该同学最后得出的结论为:当加入少量CuCl2溶液时,生成氢气的速率会大大提高.但当加入的CuCl2溶液超过一定量时,生成氢气的速率反而会下降.
请分析氢气生成速率下降的主要原因
查看习题详情和答案>>
(1)要加快上述实验中气体产生的速率,还可采取的措施有
升高温度
升高温度
;适当增加盐酸浓度
适当增加盐酸浓度
(答两种);(2)实验室中现有NaCl、CuSO4、FeCl2、ZnCl2等4种溶液,可与实验中CuCl2溶液起相似作用的是
CuSO4
CuSO4
;(3)为了进一步研究氯化铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验(混合溶液) | A | B | C | D | E | F |
| 4mol/L 盐酸/mL | 60 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuCl2溶液/mL | 0 | 1.0 | 5.0 | 10 | V6 | 40 |
| H2O/mL | V7 | V8 | V9 | V10 | 20 | 0 |
60
60
,V6=20
20
,V9=35
35
;②该同学最后得出的结论为:当加入少量CuCl2溶液时,生成氢气的速率会大大提高.但当加入的CuCl2溶液超过一定量时,生成氢气的速率反而会下降.
请分析氢气生成速率下降的主要原因
生成Cu覆盖在Zn表面,降低了Zn与酸溶液的接触面积
生成Cu覆盖在Zn表面,降低了Zn与酸溶液的接触面积
.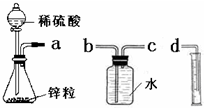 某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.(1)为达到本实验目的其装置连接顺序为:
a连
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸 | 10mL | t1 | v1 |
| 4mol/L硫酸 | 10mL | t2 | v2 |
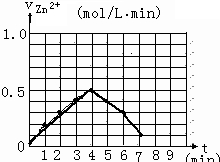
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请解释0到4mim时该化学反应速率随时间变化的原因:
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有:
 查看习题详情和答案>>
查看习题详情和答案>>