网址:http://m.1010jiajiao.com/timu3_id_54228[举报]
已知:当羟基与双键碳原子相连接时,易发生如下转化: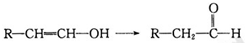 化学式为C11H10O4的有机物A有如下的转化关系
化学式为C11H10O4的有机物A有如下的转化关系
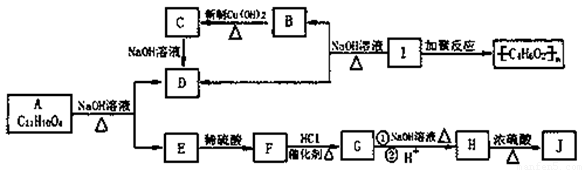
其中F为苯的二元对位取代物,分子中含有羟基、羧基及碳碳双键,存在顺反异构现象,J分子中有三十六元环状结构,其中一个六元环含有两个酯基。试回答:
(1)写出有机物结构简式:I:____ ,J:
(2)指出F→G的反应类型:
(3)写出A→E+D 的化学反应方程式:
(4)写出G与NaOH溶液共热的化学反应方程式:
(5)F的同分异构体F1也为苯的二元对位取代物,且与F具有相同的官能团,但其不存在顺反异构现象,则F1的结构简式为 。
查看习题详情和答案>>
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:(1)以上步骤有错误的是(填编号)
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无响”)
(3)判断滴定终点的现象是:锥形瓶中溶液从
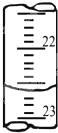
(4)右图是某次滴定时的滴定管中的液面,其读数为
(5)根据下列数据:请计算待测盐酸溶液的浓度:
| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ,用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号)
②步骤Ⅳ中滴定时眼睛应
③若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | 22.60 |
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并直接注入NaOH溶液至“0”刻度线以上
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并直接注入NaOH溶液至“0”刻度线以上②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:(1)以上步骤有错误的是(填编号)
(2)步骤⑤中,滴定前锥形瓶有少量水,在滴定操作时将导致测定结果(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:当滴入最后一滴溶液时,锥形瓶中溶液从无色变为浅红色,且
(4)图是某次滴定时的滴定管中的液面,其读数为
(5)根据下列数据:请计算待测盐酸溶液的浓度:
| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
(7分)、某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:(1)以上步骤有错误的是(填编号) ,
该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) ______ ;
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无响”)____________ ;
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色;
(4)右图是某次滴定时的滴定管中的液面,其读数为 mL;
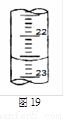
(5)根据下列数据:请计算待测盐酸溶液的浓度: mol/L。
|
滴定次数 |
待测体积(ml) |
标准烧碱体积(ml) |
|
|
滴定前读数 |
滴定后读数 |
||
|
第一次 |
20.00 |
0.40 |
20.40 |
|
第二次 |
20.00 |
4.00 |
24.00 |
|
第三次 |
20.00 |
2.00 |
24.10 |
查看习题详情和答案>>