网址:http://m.1010jiajiao.com/timu3_id_53651[举报]
(1)写出瓦斯爆炸的化学方程式___________________________________________________。
(2)可燃性气体的爆炸都有一个爆炸极限,所谓爆炸极限是指可燃气体(或蒸汽或粉尘等)与空气混合后,遇火产生爆炸的最高或最低浓度(通常以体积百分数表示)。下表是甲烷在空气和纯氧气中的爆炸极限。
| 空气中 | 纯氧气中 |
甲烷的爆炸极限 | 5.0—15% | 5.0—60% |
下面是瓦斯和空气组成的混合气体中瓦斯的体积含量,从是否能够爆炸方面考虑,不安全的是( )
A.3% B.10% C.30% D.60%
(3)请分析人为什么在瓦斯爆炸的矿中会窒息死亡:
_____________________________________________________________________。
(4)由矿井中的瓦斯爆炸,根据你的化学实验经验,你可以得出什么启示?(提示:对可燃性气体的加热、点燃操作应该注意的问题)
_____________________________________________________________________。
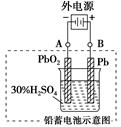
查看习题详情和答案>>铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
铅蓄电池示意图
Pb+PbO2+4H++2![]()
![]() 2PbSO4+2H2O
2PbSO4+2H2O
请完成下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是
____________________________________________________;电解液中H2SO4的浓度将变_________________;当外电路通过1 mol电子时,理论上负极板的质量增加
_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成
_____________________、B电极上生成_____________________,此时铅蓄电池的正负极的极性将__________________________________。
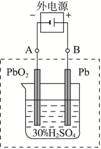
查看习题详情和答案>>请完成下列问题(不考虑氢、氧的氧化还原):

铅蓄电池示意图
(1)放电时:正极的电极反应式是____________;负极的电极反应式是____________________ _____________________________________________________________________。
(2)电解液中H2SO4的浓度将变__________;当外电路通过1 mol电子时,理论上负极板的质量增加__________g。
查看习题详情和答案>>Ph+PbO2+4H++![]()
![]() 2PbSO4+2H2O
2PbSO4+2H2O
试回答下列问题(不考虑氢、氧的氧化还原):

铅蓄电池示意图
图1-2-17
(1)放电时:正极的电极反应式是________________________________________;
电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按题图连接,电解一段时间后,则在A电极上生成________、B电极上生成________,此时铅蓄电池的正负极的极性将________。
查看习题详情和答案>>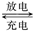 2PbSO4+2H2O
2PbSO4+2H2O