29.如下图所示,从A出发可发生一系列化学反应,其中化合物B以铁做催化剂进行溴代时,一溴代物只有两种,F遇氯化铁溶液不变色,G为高分子化合物。
|
|
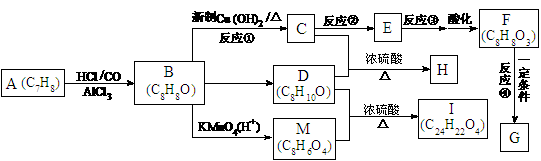 已知:
已知: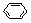
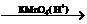
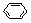
请根据上述信息填空:
(1)写出反应类型:反应①_____________________,反应④______________________。
(2)若反应③的条件为氢氧化钠溶液、加热,则反应②的条件可能为________(选填答案编号)。
A.溴水、光照 B.液溴、铁粉
C.氢溴酸、加热 D.氯气、光照
(3)H的结构简式为_______________________________________________。
(4)与C互为同分异构体且均属于酯类的芳香族的化合物共有_____种,其中苯环上的一取代物有四种的物质的结构简式为_____________________________________。
(5)写出下列反应的化学方程式:
F→G:________________________________________________________________;
D + M →I:____________________________________________________________。
27.CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:

已知:①钴与盐酸反应的化学方程式为:Co+2HCl→CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为____________________________________________________。
(2)加入碳酸钠调节pH至a,a的范围是_______________________________________。
(3)操作Ⅰ包含3个实验基本操作,它们依次是___________________________和过滤。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是____________________________。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是___________________________。
(6)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,除去不溶性杂质后,再进行_______________操作。
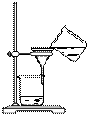
26.实验室制取乙酸丁酯的实验装置有以下甲、乙两种装置可供选用。
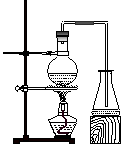
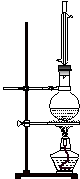
(甲) (乙)
制备乙酸丁酯所涉及的有关物质的物理性质见下表
|
l
|
l
乙酸 |
l 1-丁醇 |
l
乙酸丁酯 |
|
l
熔点(℃) |
l
16.6 |
l -89.5 |
l
-73.5 |
|
l
沸点(℃) |
l
117.9 |
l
117 |
l 126.3 |
|
l
密度(g/cm3) |
l
1.05 |
l
0.81 |
l
0.88 |
|
l 水溶性 |
l 互溶 |
l
可溶 l (9g/100g水) |
l 微溶 |
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的
理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
①___________________________________________________________________,
②___________________________________________________________________。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。
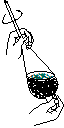
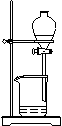

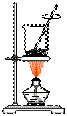
 A
B C
D
A
B C
D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______
______________________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
25.氨是一种重要的化工原料,氨的合成与应用是当今重要研究内容之一。不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2起始物质的量之比为1∶3)。
l
 压强(Mpa) 压强(Mpa)l  氨的平 氨的平l 衡含量(%) l l 温度(℃) |
l 0.1 |
l 10 |
l 20 |
l 30 |
l 60 |
l 100 |
|
l 200 |
l 15.3 |
l 81.5 |
l 86.4 |
l 89.9 |
l 95.4 |
l 98.8 |
|
l 300 |
l 2.2 |
l 52.0 |
l 64.2 |
l 71.0 |
l 84.2 |
l 92.6 |
|
l 400 |
l 0.4 |
l 25.1 |
l 38.2 |
l 47.0 |
l 65.2 |
l 79.8 |
|
l 500 |
l 0.1 |
l 10.6 |
l 19.1 |
l 26.4 |
l 42.2 |
l 57.5 |
|
l 600 |
l 0.05 |
l 4.5 |
l 9.1 |
l 13.8 |
l 23.1 |
l 31.4 |
回答下列有关问题:
(1)利用表中数据推断得出合成氨的反应是__________反应(填“放热”、“吸热”或“无热量变化”)。
(2)根据表中数据,在200℃和100MPa时,平衡体系中NH3的物质的量分数最高,而实际工业生产不选用该条件的主要原因是___________________________________。
(3)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“可能增大也可能减小”):
|
l |
l 反应速率 |
l 平衡常数K |
l 氨的体积分数 |
|
l 变化情况 |
l l |
l |
l |
(4)将1molH2和1molN2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,测得NH3的物质的量为0.3mol,此时若移走0.5molH2和0.5molN2,则反应达到新的平衡时,NH3的物质的量为_____________(选填答案编号)。
A.0.3mol B.0.15mol C.小于0.15mol D.大于0.15mol,小于0.3mol
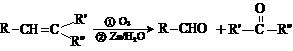
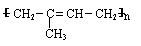 (1)天然橡胶主要成分的结构为:
(1)天然橡胶主要成分的结构为: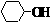 )合成己二醛(
)合成己二醛( 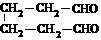 )各步反应的化学方程式:
)各步反应的化学方程式: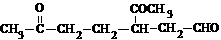 。A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环。请推导A的结构简式。
。A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环。请推导A的结构简式。