12、(17分)向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂, t5-t6 阶段为升高温度,图一中t0-t1阶段c(B)未画出。
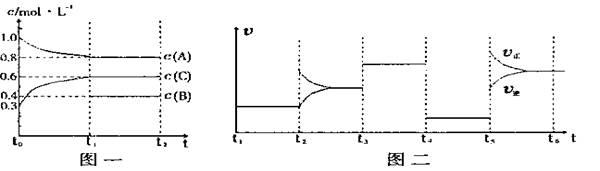
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
 (2)t4-t5阶段改变的条件为
,B的起始物质的量为
。
(2)t4-t5阶段改变的条件为
,B的起始物质的量为
。
(3)此反应的化学方程式可表示为 ,该反应为
(填“放”或“吸”)热反应。
(4)各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
9、(14分)设反应①Fe(s)+CO2(g) ) FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T/K |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1 173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是 (填“放”或“吸”)热反应。
 (2)现有反应③H2(g)+CO2(g)
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g);△H=Q3平衡常数为K3。
CO(g)+H2O(g);△H=Q3平衡常数为K3。
根据反应①与②推导出K1、K2、K3的关系式K3= ;
可推断反应③是 (填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右
移,可采取的措施有 。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量 E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3= 。


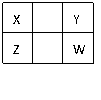 A.Z元素的最高化合价可能比Y元素的高
A.Z元素的最高化合价可能比Y元素的高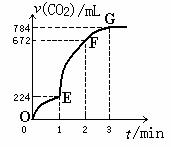 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验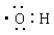
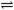 HS-+ OH-
HS-+ OH-
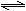 2NH3(g)
2NH3(g)