摘要:向一体积不变的密闭容器中加入2mol A.0.6molC和一定量的B三种气体.一定条件下发生反应.各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件.平衡体系中反应速率随时间变化的情况.且四个阶段都各改变一种不同的条件.已知t3-t4阶段为使用催化剂, t5-t6 阶段为升高温度.图一中t0-t1阶段c(B)未画出. (1)若t1=15min.则t0-t1阶段以C浓度变化表示的反应速率为v(C)= . (2)t4-t5阶段改变的条件为 .B的起始物质的量为 . (3)此反应的化学方程式可表示为 .该反应为 热反应. (4)各阶段平衡时对应的平衡常数如下表所示: t1-t2 t2-t3 t3-t4 t4-t5 t5-t6 K1 K2 K3 K4 K5 则K1= .K1.K2.K3.K4.K5之间的关系为 (用“> .“< 或“= 连接)
网址:http://m.1010jiajiao.com/timu3_id_410274[举报]
向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3-t4阶段为使用催化剂,t5-t6 阶段为升高温度,图一中t0-t1阶段c(B)未画出.
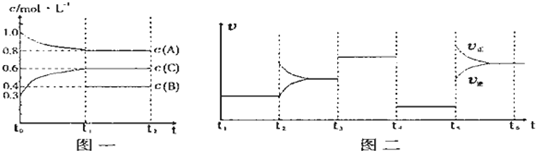
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=
(2)t4-t5阶段改变的条件为
(3)此反应的化学方程式可表示为
(填“放”或“吸”)热反应.
(4)各阶段平衡时对应的平衡常数如下表所示:
则K1=
查看习题详情和答案>>

(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=
0.02mol/(L?min)
0.02mol/(L?min)
.(2)t4-t5阶段改变的条件为
减小压强
减小压强
,B的起始物质的量为1.0mol
1.0mol
.(3)此反应的化学方程式可表示为
2A(g)+B(g) 3C(g)
3C(g)
 3C(g)
3C(g)2A(g)+B(g) 3C(g)
3C(g)
,该反应为 3C(g)
3C(g)吸
吸
(填“放”或“吸”)热反应.
(4)各阶段平衡时对应的平衡常数如下表所示:
| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
0.84
0.84
(保留两位小数),K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5
K1=K2=K3=K4<K5
(用“>”、“<”或“=”连接)向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.

(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=
(2)t4~t5阶段改变的条件为
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)
①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:
(5)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为
查看习题详情和答案>>

(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=
0.02mol/(L?min)
0.02mol/(L?min)
.(2)t4~t5阶段改变的条件为
减小压强
减小压强
,B的起始物质的量为1.0mol
1.0mol
.(3)判断图一中可逆反应达到平衡状态的依据是(填序号)
④
④
.①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:
2A(g)+B(g) 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol
 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol2A(g)+B(g) 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol
. 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol(5)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为
a+
=2.4,b+
=1.2
| 2c |
| 3 |
| c |
| 3 |
a+
=2.4,b+
=1.2
.| 2c |
| 3 |
| c |
| 3 |
向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如附图一所示.附图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出.

(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=
(2)t4-t5阶段改变的条件为
K1、K2、K3、K4、K5之间的关系为
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
(4)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡,a、b、c要满足的条件为
查看习题详情和答案>>

(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=
0.02mol/(L?min)
0.02mol/(L?min)
.(2)t4-t5阶段改变的条件为
减小压强
减小压强
,B的起始物质的量为1.0mol
1.0mol
.各阶段平衡时对应的平衡常数如下表所示:| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
K1=K2=K3=K4<K5
K1=K2=K3=K4<K5
求出K1(写过程).(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
2A(g)+B(g) 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol
 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol2A(g)+B(g) 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol
. 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol(4)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡,a、b、c要满足的条件为
a+
c=2.4,b+
c=1.2
| 2 |
| 3 |
| 1 |
| 3 |
a+
c=2.4,b+
c=1.2
.| 2 |
| 3 |
| 1 |
| 3 |
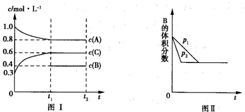 向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质的物质的量浓度随时间变化的曲线如图Ⅰ所示.若保持其他条件不变,压强分别为p1和p2时,B的体积分数与时间的关系曲线如图Ⅱ所示.下列结论正确的是( )
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质的物质的量浓度随时间变化的曲线如图Ⅰ所示.若保持其他条件不变,压强分别为p1和p2时,B的体积分数与时间的关系曲线如图Ⅱ所示.下列结论正确的是( )
查看习题详情和答案>>
向一体积不变的密闭容器中加入2mol X、0.6mol Z和一定量的Y三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示,其中t0-t1阶段C(Y)未画出.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段各改变一种不同的条件(浓度、温度、压强、催化剂),其中t3-t4阶段为使用催化剂.则下列说法不正确的是( )
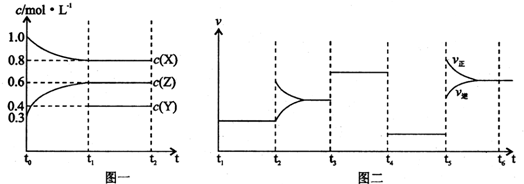

| A、Y的起始物质的量为1.0 mol | ||||
| B、t4-t5阶段改变的条件为减小压强;t5-t6是升高温度 | ||||
| C、此温度下该反应的化学方程式为2X(g)+Y(g)?2Z(g) | ||||
D、在相同条件下,若起始时容器中加入a mol X b mol Y和c mol Z,要达到t1时刻同样的平衡,a,b,c要满足的条件为a+
|