4.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是 ( )
|
|
物质 |
试剂 |
分离方法 |
|
① |
硝酸钾(氯化钠) |
蒸馏水 |
降温结晶 |
|
② |
二氧化碳(氯化氢) |
饱和碳酸钠溶液 |
洗气 |
|
③ |
乙醇(水) |
生石灰 |
蒸馏 |
|
④ |
苯(苯酚) |
浓溴水 |
分液 |
A.①② B.①③ C.只有③ D.③④
31.向一密闭容器中加入2molA、0.6molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如附图一所示。附图二为t2时刻后改变的反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
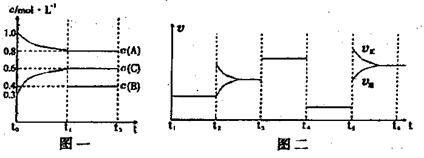
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为
K1 K2 K3 K4 K5(用>、<、=)
(3)在相同条件下,若起始时容器中加入a molA、b mol B和cmolC,要达到t1时刻同样的平衡(各物质的百分含量相同),a、b、c要满足的条件为 。(含a,b,c的代数式表示)
附加题:(本题共10分)
莫尔是一位著名分析化学家,以他命名的莫尔盐[(NH4)2Fe(SO4)2·6H2O]是化学分析中重要的试剂,常作为一种稳定的还原剂使用,某同学模拟制备莫尔盐并利用莫尔盐测定高锰酸钾溶液的浓度。他的实验过程如下:
A中放有2g废铁屑(含铁锈,其他杂质不与稀硫酸反应),烧杯中盛有饱和硫酸铵溶液,实验时打开a,关闭b,从分液漏斗内向A中加一定量的稀硫酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水,再降温结晶获得莫尔盐晶体。然后用莫尔盐测定未知高锰酸钾溶液的浓度。
试回答下列问题:
(1)请写出在蒸发皿中制得莫尔盐的化学方程式是:
(2)滴加稀H2SO4时,发现其反应速率比同浓度硫酸与纯铁粉反应快,其原因是 。
(3)取3.92g莫尔盐晶体配成100mL溶液,用酸式滴定管取20.00mL注入锥形瓶中,然后用未知浓度的酸性高锰酸钾溶液进行滴定,消耗该溶液的体积为8.00mL。
①配平下列反应式:
Fe2++ MnO4-+ H+ - Mn2++ Fe3++ H2O
②用 (酸式或碱式)滴定管盛装高锰酸钾溶液
③高锰酸钾溶液的物质的量浓度是 。
30.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大小”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 (填序号)。
A.Ba(OH)2溶液 B.BaC12溶液
C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断错误的,理由是 。
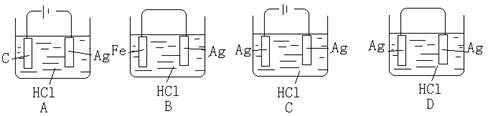
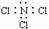 下列叙述正确的是
下列叙述正确的是
 D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-
D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-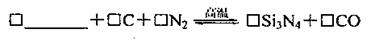
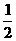 O2(g)=CO2(g);
△H=-110.5kJ·mol-1
O2(g)=CO2(g);
△H=-110.5kJ·mol-1