20、磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
|
成分 |
CaO |
P2O5 |
SO3 |
CO2 |
|
质量分数(%) |
47.30 |
28.40 |
3.50 |
6.10 |
(1)磷灰石中,碳元素的质量分数为___________%(保留两位小数)。
(2)取100 g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4_________________g(保留两位小数)。
(3)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1 mol/L)与其反应,结果Ca、S、P元素全部以CaSO4 和Ca(H2PO4)2 的形式存在,求m的值。
(4)若工厂用磷灰石中Ca3(PO4)2 为原料同时生产H3PO4和Ca(H2PO4)2 ,市场上1mol H3PO4的利润是a元,1 mol Ca(H2PO4)2的利润是b元。由100 mol原料Ca3(PO4)2 制得的二种产品的利润共为y元,产品H3PO4和Ca(H2PO4)2的物质的量之比
 =x,试求y与x的关系式。
=x,试求y与x的关系式。
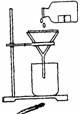 某学生发现滴瓶中溶液里有悬浊物,拟用右图所示操作进行过滤,错误的
某学生发现滴瓶中溶液里有悬浊物,拟用右图所示操作进行过滤,错误的  21(A)聚合铁(简称PFS)化学式为:
21(A)聚合铁(简称PFS)化学式为: 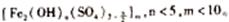 现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。  (B)
(B) =___________________________。然而将上述镁带燃烧过程在相同情况下重复多次。固体残渣中实际所得Mg(NH2)2和MgNH的物质的量之比总是小于该值,分析可能的原因是______________________________________________________。
=___________________________。然而将上述镁带燃烧过程在相同情况下重复多次。固体残渣中实际所得Mg(NH2)2和MgNH的物质的量之比总是小于该值,分析可能的原因是______________________________________________________。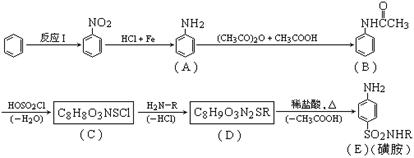
 (4)电浮选凝聚法是工业上采用的一种污水处理方法,图20
(4)电浮选凝聚法是工业上采用的一种污水处理方法,图20