17.(7分)在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:________ (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质.
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
根据所学知识判断,___________同学(填甲或乙)的推断是正确的口用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
 18.(15分)某校课外实验小组同学设计了如图实验装置进行实验
18.(15分)某校课外实验小组同学设计了如图实验装置进行实验
(夹持装置已略去)。
(1)该小组同学用该装置进行“乙炔的制取及其燃烧
性质的验、证”实验。
①仪器a的名称是_____________,实验开始时
使用该仪器的操作方法是_____________;
②点燃乙炔前,需要验纯。简述验纯的操作方
法:______________________。
③在导管口c处点燃乙炔,观察到的现象是
(2)该装置还可用于制取并收集少量其他气体。请帮助该小组同学完成下表。
|
制取的气体 |
药品 |
化学方程式 |
|
O2 |
_________、___________ |
_________________ |
|
________________ |
NaOH浓溶液、Al |
_________________ |
(3)某同学用该装置进行实验,确定某饱和醇的结构。反应前,先对量气管进行第一次凑数;反应后,待装置温度冷却到室温,再对量气管进行第二次读数(表中读数已折合成标准状况下的数值)。实验数据记录如下:
|
|
饱和醇的质量 |
金属钠的质量 |
量气管最一次读数 |
量气管第二次读数 |
|
① |
0.62g |
5.0g(足量) |
40mL |
264mL |
|
② |
0.31g |
2.5g(足量) |
40mL |
152mL |
已知该饱和醇的相对分子质量为62。根据上述数据可确定该.饱和醇的结构式为__________________。
15.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应: 2A(g)+B(g)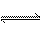 2C(g);△H<0达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是 ( )
2C(g);△H<0达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是 ( )
|
|
X |
Y |
|
A |
再加入A |
B的转化率 |
|
B |
再加入C |
A的体积分数 |
|
C |
缩小体积 |
A的转化率 |
|
D |
升高温度 |
混合气体密度 |
11.用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度,滴定管如图甲、乙所示。从下表中选出的正确组合是 ( )
 |
锥形瓶 中溶液 |
滴定管 中溶液 |
选用 指示剂 |
选用 滴定管 |
|
A |
碱 |
酸 |
石蕊 |
乙 |
|
B |
酸 |
碱 |
酚酞 |
甲 |
|
C |
碱 |
酸 |
甲基橙 |
甲 |
|
D |
酸 |
碱 |
酚酞 |
乙 |

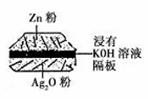 12.如图:一种微型钮扣电池,其电极材料分别为Ag2O和Zn,电解质溶液是KOH 溶液。负极的反应式:Zn-2e-+2OH-==ZnO+H2O,该电池总反应式为:Zn+Ag2O==ZnO+2Ag。 根据以上提供的资料,判断下列说法正确的是 ( )
12.如图:一种微型钮扣电池,其电极材料分别为Ag2O和Zn,电解质溶液是KOH 溶液。负极的反应式:Zn-2e-+2OH-==ZnO+H2O,该电池总反应式为:Zn+Ag2O==ZnO+2Ag。 根据以上提供的资料,判断下列说法正确的是 ( )
A.正极的反应式:Ag2O+2e-+H2O==2Ag+2OH-
B.放电时负极附近溶液的pH不变
C.放电时每消耗6.5g Zn,转移电子0.1mol
D.放电时溶液中阴离子向正极方向移动,阳离子向负极方向移动
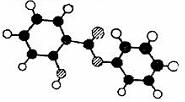 23.(11分)萨罗(Salol)是一种消毒剂,它的分子式为
23.(11分)萨罗(Salol)是一种消毒剂,它的分子式为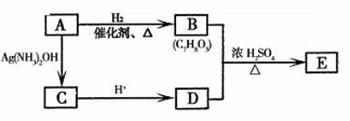 (1)从(2)确定的同分异构体中任选一种,指定为下列框图中的A。
(1)从(2)确定的同分异构体中任选一种,指定为下列框图中的A。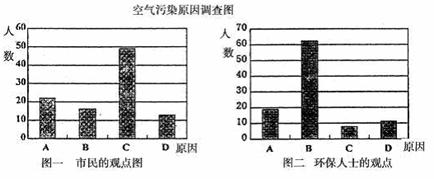 研究性学习小组就造成该城市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
研究性学习小组就造成该城市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:  +H2O N2H4+H2O
+H2O N2H4+H2O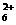 +OH- N2H
+OH- N2H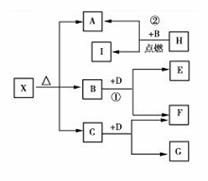 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。
已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。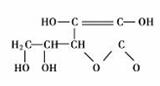 14.2006年3月2日英国《泰晤士报》报道指出:汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如图)可能会相互作用生成苯。下列说法不正确的是 ( )
14.2006年3月2日英国《泰晤士报》报道指出:汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如图)可能会相互作用生成苯。下列说法不正确的是 ( )