20.(本题共6分) 在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类。请选出各组的例外元素,并将该组其他元素的可能归属按所给6种类型的编号填入表内。
|
元素组 |
例外元素 |
其他元素所属类型编号 |
|
⑴S、N、Na、Mg |
|
|
|
⑵P、Sb、Sn、As |
|
|
|
⑶Rb、B、Te、Fe |
|
|
归属类型:①主族元素 ②过渡元素 ③同周期元素 ④同族元素 ⑤金属元素 ⑥非金属元素
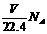
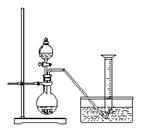 (本题共11分) 某同学设计了如下方案,来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况)。
(本题共11分) 某同学设计了如下方案,来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况)。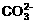 、
、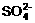 、Na+、
、Na+、 、K+、Mg2+ 七种离子中的某几种。经实验:
、K+、Mg2+ 七种离子中的某几种。经实验: 白色沉淀
白色沉淀 放出使紫色石蕊试液变蓝的气体
放出使紫色石蕊试液变蓝的气体