29.(10分)下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径 (10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中,第一电离能最小的是 (填编号)
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是 (写分子式)。元素⑨和⑩形成的化合物的化学式为 ,它是一种重要的结构材料,推测它应是属于 晶体;元素①的原子价电子排布式是 。
(3)元素③有一种单质为O3,其分子呈V形结构,键角116.5°。三个原子以一个为中心,与另外两个原子分别构成一个非极性键,中心原子再提供2个电子,旁边两原子各提供一个电子构成一个特殊的共价键--三个原子均等地享有这四个电子,这种特殊的共价键的类型是 键(填σ或π),在高中化学中有一种常见分子的结合方式与O3相同,它是 (填分子式)。
(4)③和⑨两元素比较,非金属性较弱的是 (填名称),可以验证你的结论的是下列中的 (填序号)。
A、气态氢化物的挥发性和稳定性
B、单质分子中的键能
C、两元素的电负性
D、含氧酸的酸性
E、氢化物中X-H键的键长(X代表③和⑨两元素)
F、两单质在自然界的存在形式
27.(10分)
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
|
烯类化合物 |
相对速率 |
|
(CH3)2C=CHCH3 |
10.4 |
|
CH3CH=CH2 |
2.03 |
|
CH2=CH2 |
1.00 |
|
CH2=CHBr |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系(请写出3点) 。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是 (填代号)。
A.(CH3)2C=C(CH3)2, B.CH3CH=CHCH3
C.CH2=CH2 D.CH2=CHCl
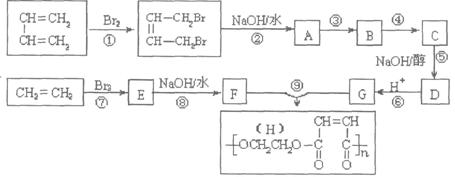
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
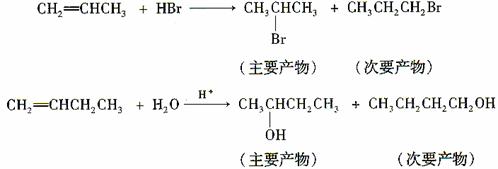
下列框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有4个碳原子、1个溴原子、1种氢原子。
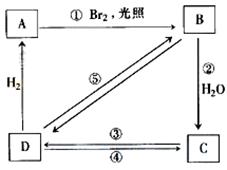
上述框图中,B的结构简式为 ;属于取代反应的有 (填框图中序号),属于消去反应的有 (填序号);写出反应④的化学方程式(只写主要产物,标明反应条件): 。
26、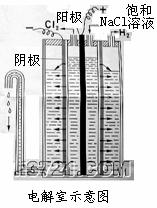 (12分)氢氧化钠由电解氯化钠饱和溶液制得,根据所用电极和电解槽的不同,分为隔膜法和汞阴极法两种。
(12分)氢氧化钠由电解氯化钠饱和溶液制得,根据所用电极和电解槽的不同,分为隔膜法和汞阴极法两种。
Ⅰ、隔膜法以石墨为阳极,以铁丝网为阴极,并用石棉隔膜将阳极区和阴极区分离开来。
(1)除发生我们熟知的主反应外,还会发生一些对生产不利的副反应。例如:
①在食盐水浓度不高时,阳极生成的氯气将溶于盐水中发生反应,其化学方程式为 ;其原因是 。
②在食盐水浓度不高时,阳极还会发生一个电极反应,其电极方程式为 。
(2)电解后的电解液含氢氧化钠130-145Kg/m3,通过蒸发浓缩,
(写化学式) 以晶体析出,过滤后,再蒸发浓缩母液,可得到固体氢氧化钠。
Ⅱ、汞阴极法是以流动的液态汞(可循环使用)作阴极,以石墨作阳极,电解槽由电解室与解汞室两部分组成。
(3)在电解室电解饱和食盐水,生成钠汞齐。发生的总反应方程式为:
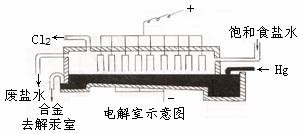 2NaCl+2nHg=Cl2↑+2(Na·nHg)。
2NaCl+2nHg=Cl2↑+2(Na·nHg)。
请写出阴极上发生的电极反应方程式: 。
|
(5)在解汞室中,钠汞齐与水反应的必需条件是 ,其原因是 。
23.(11分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成
______________________________________________________________ 。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布褪色? |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①_____________ ____________。 ②_____________ ____________。 ③____________ _____________。 ④ H2O使布条褪色 |
实验1:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验2:_______________ ______________。 实验3:把红色布条放在水里,布条不褪色。 |
__________ __________ __________ |
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3
 HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3- CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
HClO  H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中_________________________;
②氯气和碳酸钠按照1∶1的比例恰好反应_______________________;
③将过量的氯气通入到少量的碳酸钠溶液___________________。
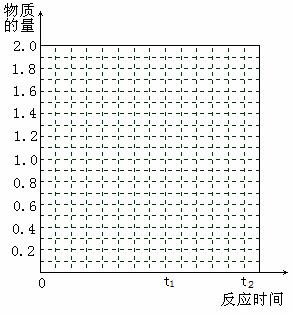 (10分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
(10分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
 2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题: