18.(8分)某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
|
|
实验操作 |
实验现象 |
|
步骤1 |
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 |
有少量气泡产生,溶液的黄绿色褪去 |
|
步骤2 |
将第一份滤液与稀盐酸混合 |
产生大量气泡 |
|
步骤3 |
将第二份滤液加热 |
溶液变浑浊,且有大量无色气体产生 |
⑴步骤1过滤的目的是__________________________________________。
⑵步骤2、步骤3的实验目的都是 ;为达到该实验目的,还可以采取的方法是 。
⑶请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大: 。
17.(7分)分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
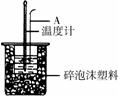 (2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的 (填“偏大”、“偏小”或“无影响”);
(填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容
c=4.18J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)
____ _____;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
|
实验序号 |
起始温度t1℃ |
终止温度t2℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热 =_____________;
=_____________;
(5) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
 )+ c(HC2O
)+ c(HC2O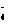 )
)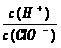 减小 B.通入少量SO2,溶液漂白性增强
减小 B.通入少量SO2,溶液漂白性增强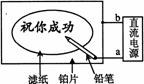
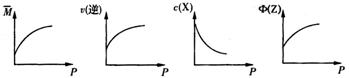
 aZ(g),平衡后,Z的体积分数为b%,若维持容器容积和温度不变,1.2molX、0.4molY和1.2molZ为起始物质,达到平衡后,Z的体积分数也为b%。平衡后若缩小容器体积,混合气体平均相对分子质量
aZ(g),平衡后,Z的体积分数为b%,若维持容器容积和温度不变,1.2molX、0.4molY和1.2molZ为起始物质,达到平衡后,Z的体积分数也为b%。平衡后若缩小容器体积,混合气体平均相对分子质量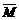 、逆反应速率v(逆),X的浓度c(X)和Z的体积分数Φ(Z),随压强(P)的变化,一定符合的是
、逆反应速率v(逆),X的浓度c(X)和Z的体积分数Φ(Z),随压强(P)的变化,一定符合的是