22.(12分)下表中表示元素周期表的边界结构。①-⑤分别表示元素周期表中对应位置的元素。
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
③ |
④ |
⑤ |
|
|
|||||||||
|
① |
|
|
|
|
|
|
|
|
||||||||||
|
② |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
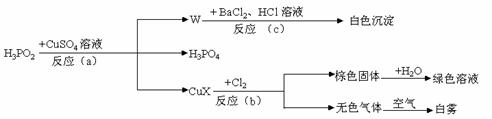
(1)短周期元素甲的最外层电子数是两个内层电子数之差,则甲元素的元素符号为_____。
 (2)元素乙的M层电子数只有甲元素的一半,则乙原子半径与甲原子半径比较:________>________(用化学式表示,下同);甲、乙的最高价氧化物水化物的酸性强弱为:________>________。
(2)元素乙的M层电子数只有甲元素的一半,则乙原子半径与甲原子半径比较:________>________(用化学式表示,下同);甲、乙的最高价氧化物水化物的酸性强弱为:________>________。
(3)元素⑤的单质与元素④的氢化物反应的化学方程式为:_________________________,元素③氢化物的电子式为_______,元素④在与⑤形成化合物时,元素④化合物中显_____价。
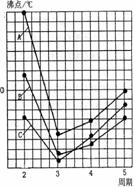
(4)右图中A、B、C三条曲线分别表示③、④、⑤三种元素所在主族元素的气态氢化物的沸点,其中表示元素④所在主族元素气态氢化物沸点的是曲线 ;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是 ;A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物沸点的原因是 。
18.(10分)(1)已知白磷的燃烧热为2378.0 kJ/mol,写出表示白磷的燃烧热的热化学方程式:_____________________________________________________。
(2)强酸强碱反应的中和热为:57.3kJ/mol,将1.00L、1mol/LH3PO4和1.00L、1mol/LNaOH溶液反应,放出的热量为Q1,则Q1______(填“大于”、“小于”、“等于”)57.3kJ,其原因是___________________________________________若再往溶液中加入1.00L、1mol/LNaOH溶液,完全反应后又放出热量为Q2,则Q1______(填“大于”、“小于”、“等于”)Q2。
(3)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H-I(g)+297kJ即H-I键的键能为297kJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297kJ的能量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。化学反应的能量变化(△H)与反应物和生成物的键能有关。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/ kJ·mol–1 |
197 |
360 |
499 |
X |
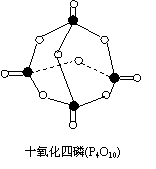
白磷完全燃烧的产物结构如图所示,则上表中X= 。
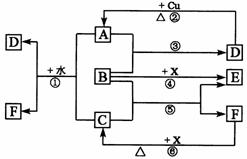 试回答下列问题:
试回答下列问题: