网址:http://m.1010jiajiao.com/timu3_id_37255[举报]
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫.
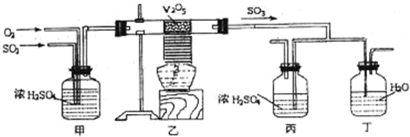
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:
| ||
| ||
(2)如图中的乙、丙分别相当于工业上制取硫酸装置中的:
(3)丙中的现象为
(4)如表是压强对SO2平衡转化率的影响
| 压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |

请回答下列问题:
(1)写出FeS2与氧气反应的化学方程式:____________________________。
(2)从乙装置中出来的气体有__________________________________________。
(3)写出上图丙装置的作用__________________________________________。
(4)在装置乙的反应器内要求氧气的量要比二氧化硫的量多一倍左右,实验时你是如何控制与估计的?____________________________。
(5)接触法制硫酸过程中,若反应热都未被利用,则每生产1 ![]() 2SO3(g);ΔH=-98.3 kJ·mol-1的热量能在生产过程中得到充分利用(其他反应热不计),则每生产1
2SO3(g);ΔH=-98.3 kJ·mol-1的热量能在生产过程中得到充分利用(其他反应热不计),则每生产1
(6)本实验增加丁装置的目的是为了探究____________________________。
(7)本实验设计还存在的较明显缺陷是_______________________________。
查看习题详情和答案>>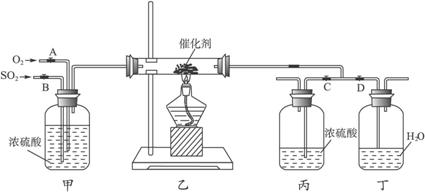
请回答下列问题:
(1)写出FeS2与氧气反应的化学方程式:_______________。
(2)从乙装置中出来的气体有_______________。
(3)写出上图丙装置的作用______________________________。
(4)在装置乙的反应器内要求氧气的量要比二氧化硫的量多一倍左右,实验时你是如何控制与估计的?_______________。
(5)接触法制硫酸过程中,若反应热都未被利用,则每生产1 ![]() 2SO3(g);ΔH=-98.3 kJ·mol-1的热量能在生产过程中得到充分利用(其他反应热不计),则每生产1
2SO3(g);ΔH=-98.3 kJ·mol-1的热量能在生产过程中得到充分利用(其他反应热不计),则每生产1
(6)本实验增加丁装置的目的是为了探究______________________________。
(7)本实验设计还存在的较明显缺陷是______________________________。
查看习题详情和答案>>工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采
用98.3%的浓硫酸吸收三氧化硫。
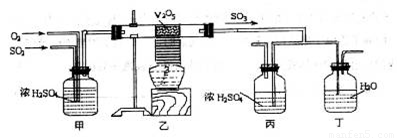
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:____________________________________;
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的:_______________、_______________;
(3)丙中的现象为_________________________、丁中的现象为_______________________。
(4)下图是压强对SO2平衡转化率的影响
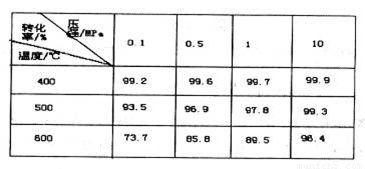
对SO2转化为SO3的反应,增大压强可使转化率________________,只所以通常采用常压操作是因为:____________________。
查看习题详情和答案>>
工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采
用98.3%的浓硫酸吸收三氧化硫。
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:____________________________________;
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的:_______________、_______________;
(3)丙中的现象为_________________________、丁中的现象为_______________________。
(4)下图是压强对SO2平衡转化率的影响
对SO2转化为SO3的反应,增大压强可使转化率________________,只所以通常采用常压操作是因为:____________________。