20.(10分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl
将所得碳酸氢钠晶体加热分解后即得到纯碱。请回答:
(1)工业所制得纯碱中常含有少量的氯化钠杂质,其原因是
。
(2)现有甲、乙、丙三个小组的的同学,欲测定某工业纯碱中碳酸钠的质量分数,分别设计并完成的实验如此下:
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重胃3.52g。
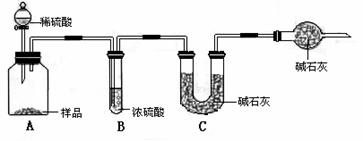
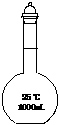
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2CaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。
请分析、计算后填表:
|
分析与 计算分组 |
计算样品中碳酸钠 的质量分数 |
对实验结果 的评价 |
实验失败的主要原因 及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
 |
|
丙组 |
|
成功 |
 |
18.“绿色化学”是21世纪化学发展的主导方向,“绿色化学”要求从根本上消除污染,是一门能彻底阻止污染产生的科学。它包括“原料的绿色化”、“化学反应的绿色化”、“产物的绿色化”等内容,其中(化学反应绿色化)要求原料物质中所有的原子完全被利用且全部转入期望的产品中。下列符合“化学反应绿色化”的是
A. 2
C2 H4+ O2 2 C2
H4O
2 C2
H4O
B.实验室里制取CO2:CaCO3+2HCl=CaCl2+CO2↑+H2O
C.2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为期望产品)
D.以铁屑、氧化铜、稀硫酸为原料制取铜:
CuO+H2SO4=CuSO4+H2O,Fe+CuSO4=FeSO4+Cu
|
|
化 学 试 题
第Ⅱ卷(非选择题 共78分)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 K 39 Ca 40 Mn 55

 2 AlN+3CO 。下列叙述正确的是
2 AlN+3CO 。下列叙述正确的是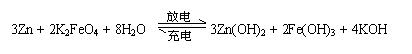 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的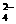 + 4H2O
+ 4H2O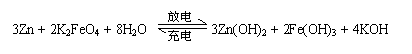
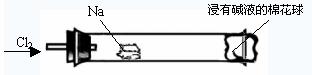 某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是