17.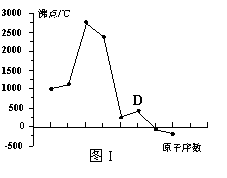 (8分) 原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
(8分) 原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
|
化合物 |
甲 |
乙 |
丙 |
|
原子个数比 |
B∶A=1∶3 |
C∶A=1∶2 |
D∶A=1∶2 |
⑴元素D在元素周期中的位置 。
⑵B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到稳定结构,则X的化学式为 ;X的熔点 金刚石(填“大于”、“等于”或“小于”)。
⑶写出图I中沸点最高的单质与NaOH溶液反应的离子式 。
16.已知五种短周期元素的原子半径及主要化合价(最高正价、最低负价)如下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.T的原子叙述最小
B.相同条件下,L、M的单质分别与稀盐酸反应速率:M>L
C.T、Q的氢化物常温常压下均为无色气体
D.M的最高价氧化物可用作耐火材料
14、在一定条件下化学反应:2SO2(g)
+ O2(g)  2SO3(g);△H=-197kJ·mol-1。现有容器固定且相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和该反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197kJ·mol-1。现有容器固定且相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和该反应放出的热量(Q)如下表所列:
|
容器 |
SO2(mol) |
O2(mol) |
He(mol) |
Q (kJ) |
|
甲 |
2 |
1 |
0 |
Q 1 |
|
乙 |
1 |
0.5 |
0 |
Q 2 |
|
丙 |
1 |
0.5 |
1 |
Q 3 |
根据以上数据,下列叙述不正确的是
A、 Q1<197 B、Q2 = Q3 C、Q1 = 2Q2 D、Q1 >2Q2
10.将质量分数为0.052(5.2%)的NaOH溶液1升(密度为1.06克/毫升)用铂电极电解,当溶液中的NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是
|
|
NaOH的质量分数 |
阳极析出物的质量(克) |
阴极析出物的质量(克) |
|
A |
0.062(6.2%) |
19 |
152 |
|
B |
0.062(6.2%) |
152 |
19 |
|
C |
0.042(4.2%) |
1.2 |
9.4 |
|
D |
0.042(4.2%) |
9.4 |
1.2 |
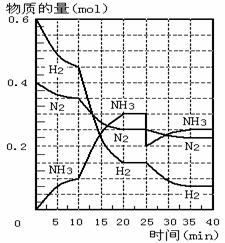 A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)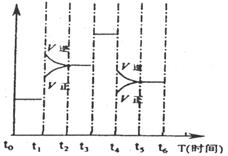 右图表示反应N2(g)+3H2(g)
⇌2NH3(g);△H<0在某一时间段中反应速率与反应过程的曲线关系图,则氨的百分含量最低的一段时间是.
右图表示反应N2(g)+3H2(g)
⇌2NH3(g);△H<0在某一时间段中反应速率与反应过程的曲线关系图,则氨的百分含量最低的一段时间是.  电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为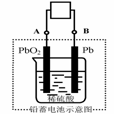 Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,
Pb+PbO2+4H++2SO42-
2PbSO4+2H2O, PbSO4
PbSO4 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )