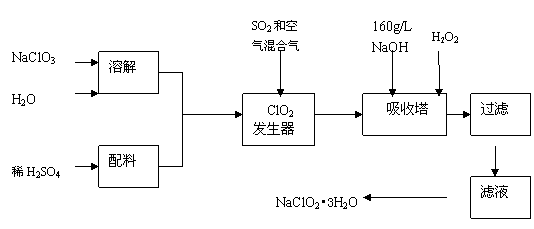
24.(8分)下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
|
|
|
|
||||||
|
a |
|
|
|
b |
c |
d |
e |
|
|
f |
|
g |
|
|
h |
|
|
⑴g的单质能与f元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
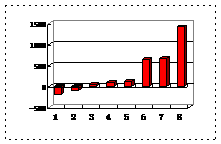
⑵第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中序号“2”代表 ,“8”代表 。
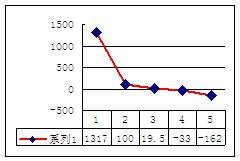
⑶a、b、c、d、e的氢化物的沸点直角坐标图(上右图),序号“5”氢化物的化学式为 ,序号“1”的氢化物的电子式: 。
⑷电子排布式为[Ne] 3S23P4的元素名称为: ;其氢化物的空间构型为: 。
21.(12分)某研究性学习小组在做氯气的喷泉实验时(装置如图),发现含有酚酞的NaOH溶液喷入烧瓶后,溶液的红色褪去。甲、乙两位同学对此现象分别做了如下推测:
甲:因为氯气与NaOH溶液反应,使溶液碱性减弱甚至呈酸性,所以溶液红色褪去。
乙:因为氯气溶于水并与水反应生成HClO,由于HClO的氧化漂白作用而使溶液褪色。
⑴验证甲同学的推测是否正确的方法是: 。
验证乙同学的推测是否正确的方法是: 。
⑵如果将NaOH溶液改成酸性KMnO4溶液,把Cl2换成SO2气体,试问用图示所给装置完成喷泉实验是否合理?________________(填“合理”或“不合理”)。如果认为不合理,请说明你的理由__________________________________________。
⑶类似“褪色喷泉实验”还有多种“变色的喷泉实验”,请你按实验要求,分别设计1个“变色喷泉实验”并填写下列表格:
|
编号 |
实验要求 |
烧杯中的溶液 |
滴管中的液体 |
烧瓶中的气体 |
|
① |
无色变红色喷泉 |
|
H2O |
|
|
② |
红色变无色喷泉 |
|
|
SO2 |
 通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式:
通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式: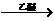 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇: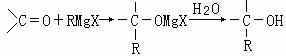
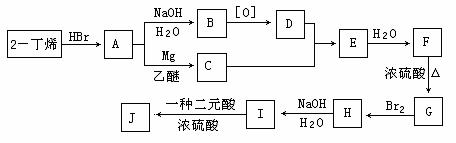
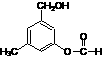 ⑷I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式
。
⑷I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式
。

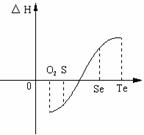 ⑵等物质的量氧气、硫、硒、碲与H2反应的焓变
⑵等物质的量氧气、硫、硒、碲与H2反应的焓变