11.共价键
|
定义 |
原子间通过共用电子对所形成的化学键,叫共价键 |
|
|
形成条件 |
一般是非金属元素之间形成共价键,成键原子具有未成对电子 |
|
|
本质 |
成键的两原子核与共用电子对的静电作用. |
|
|
表示方法 |
1.电子式:H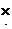 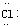 H H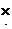 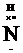 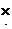 H H |
|
2.结构式 H-Cl
H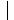 H-N-H |
||
|
形成过程 |
H×+.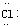  H H  |
|
|
分 类 |
分类依据:共用电子对是否发生偏移 |
|
|
非极性键 |
定义:共用电子对不偏于任何一方 特定:存在于同种原子之间 A-A单质、共价化合物、离子化合物、离子化合物中都可能含有此键。 例:Cl2、H2O2、Na2O2 |
|
|
极性键 |
定义:共用电子对偏向成键原子的一方 特点:存在于不同种原子之间 B-A 共价化合物、离子化合物中都可能含有此键 |
|
|
键 参 数 |
键能 |
折开1mol共价键所吸收的能量或形成1mol共价键所放出的能量,这个键能就 叫键能。 键能越大,键越牢固,分子越稳定。 |
|
键长 |
两成键原子核之间的平均距离叫键长。 键越短、键能较大,键越牢固,分子越稳定。 |
|
|
键角 |
分子中相邻的键和键之间的夹角叫键角。它决定分子的空间构型和分子的极性 |
10.化学键、离子键的概念
|
化 学 键 |
定义 |
晶体或分子内直接相邻的两个或多个原子之间的强烈相互作用,通常叫做化学键。 |
|
强烈的体现形式 |
使原子间形成一个整体,彼此不能发生相对移动,只能在一定平衡位置 振动。破坏这种作用需消耗较大能量。 |
|
|
离 子 键 |
定义 |
阴、阳离子间通过静电作用所形成的化学键叫做离子键。 |
|
本质 |
阴阳离子间的静电作用 |
|
|
形成条件和原因 |
稳定的阳离子 活泼金属 M  Mn+ Mn+活泼非金属 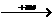 Xm- Xm-  离子键 离子键 稳定的阴离子 |
|
|
形成过程表示方法 |
mM+nX→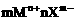 |
|
|
影响强度的因素及对物质性质的影响 |
1.离子半径:离子半径越小,作用越强。含有该键的离子化合物的熔沸点就越高。 2.离子电荷:离子电荷越多,作用越强。含有该键的离子化合物的熔沸点就越高。 |
8.同周期、同主族元素性质的递变规律
|
|
|
同周期(左 右) 右) |
同主族(上 下) 下) |
|
原子结构 |
核电荷数 |
逐渐增大 |
增大 |
|
电子层数 |
相同 |
增多 |
|
|
原子半径 |
逐渐减小 |
逐渐增大 |
|
|
|
化合价 |
最高正价由+1 +7负价数=8-族序数 +7负价数=8-族序数 |
最高正价和负价数均相同,最高正价数=族序数 |
|
元素的金属性和非金属性 |
金属性逐渐减弱,非金属性逐渐增强。 |
金属性逐渐增强,非金属性逐渐减弱。 |
|
|
单质的氧化性和还原性 |
氧化性逐渐增强,还原性逐渐减弱。 |
氧化性逐渐减弱,还原性逐渐增强。 |
|
|
最高价氧化物的水化物的酸碱性 |
酸性逐渐增强,碱性逐渐减弱。 |
酸性逐渐减弱,碱性逐渐增强。 |
|
|
气态氢化物的稳定性、还原性,水溶液的酸性。 |
稳定性逐渐增强,还原性逐渐减弱,酸性逐渐增强。 |
稳定性逐渐减弱,还原性逐渐增强,酸性逐渐减弱。 |
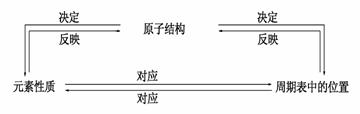
7.元素周期表的结构
|
元素周期表的结构 |
位置与结构的关系 |
|||
|
周 期 |
|
周期序数 |
元素的种数 |
1.周期序数=原子核外电子层数 2.对同主族(nA族)元素 若n≤2,则该主族某一元素的原子序数与上一周期元素的原子序数的差值为上一周期的元素种数。 若n≥3,则该主族某一元素的原子序数与上一周期元素的原子序数的差值为该周期的元素种数。 |
|
短 周 期 |
第一周期 |
2 |
||
|
第二周期 |
8 |
|||
|
第三周期 |
8 |
|||
|
长 周 期 |
第四周期 |
18 |
||
|
第五周期 |
18 |
|||
|
第六周期 |
32 |
|||
|
第七周期 |
不完全周期 |
|||
|
族 |
主 族 |
ⅠA族 ⅡA族 ⅢA族 ⅣA族 ⅤA族 ⅥA族 ⅦA族 |
由长周期元素和短周期元素共同构成的族。 |
最外层电子数 主族序数 价电子数 |
|
零 族 |
|
最外层电子数均为8个(He为2个除外) |
||
|
副 族 |
ⅠB族 ⅡB族 ⅢB族 ⅣB族 ⅤB族 ⅥB族 ⅦB族 |
只由长周期元素构成的族 |
最外层电子数一般不等于族序数(第ⅠB族、ⅡB族除外) 最外层电子数只有1-7个。 |
|
|
第Ⅷ族 |
有三列元素 |
|
6.元素金属性和非金属性强弱的判断方法
|
金 属 性 比 较 |
本质 |
原子越易失电子,金属性越强。 |
|
判 断 依 据 |
1.在金属活动顺序表中越靠前,金属性越强。 |
|
|
2.单质与水或非氧化性酸反应越剧烈,金属性越强。 |
||
|
3.单质还原性越强或离子氧化性越弱,金属性越强。 |
||
|
4.最高价氧化物对应水化物的碱性越强,金属性越强。 |
||
5.若xn++y x+ym+ 则y比x金属性强。 x+ym+ 则y比x金属性强。 |
||
|
非 金 属 性 比 较 |
本质 |
原子越易得电子,非金属性越强。 |
|
判 断 方 法 |
1.与H2化合越易,气态氢化物越稳定,非金属性越强。 |
|
|
2.单质氧化性越强,阴离子还原性越弱,非金属性越强。 |
||
|
3.最高价氧化物的水化物酸性越强,非金属性越强。 |
||
4.An-+B Bm-+A 则B比A非金属性强。 Bm-+A 则B比A非金属性强。 |
5.简单微粒半径的比较方法
|
原 子 半 径 |
1.电子层数相同时,随原子序数递增,原子半径减小 例:rNa>rMg>rAl>rSi>rp>rs>rCl 2.最外层电子数相同时,随电子层数递增原子半径增大。 例:rLi<rNa<rk<rRb<rCs |
|
离 子 半 径 |
1.同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子. 例:rCl->rCl,rFe>rFe2+>rFe3+ 2. 电子层结构相同的离子,核电荷数越大,半径越小. 例:rO2->rF->rNa+>rMg2+>rAl3+ 3. 带相同电荷的离子,电子层越多,半径越大. 例:rLi+<rNa+<rK+<rRb+<rcs+;rO2-<rs2-<rse2-<rTe2- 4. 带电荷、电子层均不同的离子可选一种离子参照比较。 例:比较rk+与rMg2+可选rNa+为参照可知rk+>rNa+>rMg2+ |
4.元素周期律
|
涵 义 |
元素性质随着元素原子序数的递增而呈周期性变化。 |
|
实 质 |
元素性质的周期性递变是核外电子排布周期性变化的必然结果。 |
|
核外电 子排布 |
最外层电子数由1递增至8(若K层为最外层则由1递增至2)而呈现周期性变化。 |
|
原子半径 |
原子半径由大到小(稀有气体元素除外)呈周期性变化。原子半径由电子层数和核电荷数多少决定,它是反映结构的一个参考数据。 |
|
主 要 化 合 价 |
最高正价由+1递变到+7,从中部开始有负价,从-4递变至-1。(稀有气体元素化合价为零),
呈周期性变化。元素主要化合价由元素原子的最外层电子数决定,一般存在下列关系: 最高正价数=最外层电子数 |
|
元素及化合物的性质 |
金属性渐弱,非金属性渐强,最高氧化物的水化 物的碱性渐弱,酸性 渐强,呈周期性变化。这是由于在一个周期内的元素,电子层数相同,最外层电子数逐渐增多,核对外层电子引力渐强,使元素原子失电子渐难,得电子渐易,故有此变化规律。 |
3. 原子核外电子排布规律
|
核 外电 子 排 布 规 律 |
1 |
各电子层最多能容纳2n2个电子 即:电子层序号 1 2 3 4 5 6 7 代表符号 K L M N O P Q 最多电子数 2 8 18 32 50 72 98 |
|
|
2 |
最外层电子数目不超过8个(K层为最外层时不超过2个)。 |
||
|
3 |
次外层电子数最多不超过18个,倒数第三层不超过32个。 |
||
|
4 |
核外电子总是尽先排满能量最低、离核最近的电子层,然后才由里往外,依次排在能量较高,离核较远的电子层。 |
||
|
注 意 事 项 |
1. 以上几点是相互联系的,不能孤立地理解,必须同时满足各项要求。 2. 上述乃核外电子排布的初步知识,只能解释1-18号元素的结构问题,若要解释更多问题,有待进一步学习核外电子排布所遵循的其它规律。 |
||
|
原 子 结 构 的 表 示 方 法 |
原子结构示意图和离子结构示意图 |
要理解图中各符号的含义。例:氯原子,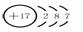 圆圈内表示原子的质子数,要注意正号;弧线表示电子层,
弧线内数字表示该层中的电子数。 圆圈内表示原子的质子数,要注意正号;弧线表示电子层,
弧线内数字表示该层中的电子数。离子结构示意图中各符号含意一样,但注意原子结构示意图中质子数等于核外电子数,而离子结构示意图中质子数与核外电子数不相等。如Cl-: 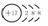 |
|
|
电子式 |
电子式是在元素符号周围用小黑点或电子式是在元素符号周围用小黑点或“×”的数目表 示该元素原子的 最外层电子数的式子。小黑点或“×”的数目即为该原子的最外层电子数。如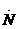 a、 a、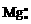 、. 、.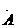 l. 、 l. 、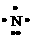 、. 、. . .,: 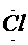 . 、: . 、: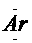 : : |
||
2.同位素及相对原子质量
|
同 位 素 |
定义 |
具有相同质子数和不同中子数的同一元素的原子互称同位素 |
|
特性 |
1. 同一元素的各种同位素化学性质几乎完全相同. 2. 天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子含量一般是不变的. |
|
|
判定 方法 |
它反映的是同种元素的不同原子间的关系.故单质、化合物间不可能是同位素。如H2和D2及H2O和D2O之间不存在同位素关系。只有质子数相同而中子数不同的原子才是同位素;如168O和188O是同位素,而且146C和147N不是同位素。 |
|
|
注意 |
天然存在的元素中,许多都有同位素(但并非所有元素都有同位素)。因而发现的原子种数多于元素的种数。 |
|
|
相对原子质量和近似相对原子质量 |
同位素的相对原子质量和近似相对原子质量 |
按初中所学的相对原子质量的求算方式是:一个原子的质量与一个12C原子质量的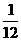 的比值。显然,所用原子质量是哪种同位素原子的质量,其结果只能是该同位素的相对原子质量。故该定义严格说应是同位素的相对原子质量。该比值的近似整值即为该同位素的近似相对原子质量,其数值等于该同位素的质量数。 的比值。显然,所用原子质量是哪种同位素原子的质量,其结果只能是该同位素的相对原子质量。故该定义严格说应是同位素的相对原子质量。该比值的近似整值即为该同位素的近似相对原子质量,其数值等于该同位素的质量数。 |
|
元素的相对原子质量和近似相对原子质量 |
因天然元素往往不只一种原子,因而用上述方法定义元素的相对原子质量就不合适了。元素的相对原子质量是用天然元素的各种同位素的相对原子质量及其原子含量算出来的平均值。数字表达式为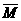 =M1×a1%+M2×a2%+……。若用同位素的质量数替代其相对原子量进行计算,其结果就是元素的近似相对原子质量(计算结果通常取整数)。我们通常采用元素的近似相对原子质量进行计算。 =M1×a1%+M2×a2%+……。若用同位素的质量数替代其相对原子量进行计算,其结果就是元素的近似相对原子质量(计算结果通常取整数)。我们通常采用元素的近似相对原子质量进行计算。 |