0 36272 36280 36286 36290 36296 36298 36302 36308 36310 36316 36322 36326 36328 36332 36338 36340 36346 36350 36352 36356 36358 36362 36364 36366 36367 36368 36370 36371 36372 36374 36376 36380 36382 36386 36388 36392 36398 36400 36406 36410 36412 36416 36422 36428 36430 36436 36440 36442 36448 36452 36458 36466 447348
 净化
净化 2NH3(g)+92.4KJ
2NH3(g)+92.4KJ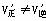 ,但与原平衡速率不等。
,但与原平衡速率不等。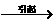 体积缩小
体积缩小 =
=