0 36338 36346 36352 36356 36362 36364 36368 36374 36376 36382 36388 36392 36394 36398 36404 36406 36412 36416 36418 36422 36424 36428 36430 36432 36433 36434 36436 36437 36438 36440 36442 36446 36448 36452 36454 36458 36464 36466 36472 36476 36478 36482 36488 36494 36496 36502 36506 36508 36514 36518 36524 36532 447348
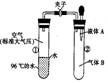 可发现试管①内的水立刻沸腾了。则液体A和气体B的组合一定不可能是下列的 ( )
可发现试管①内的水立刻沸腾了。则液体A和气体B的组合一定不可能是下列的 ( )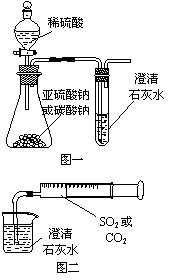 ⑴对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是:__________________________________________。
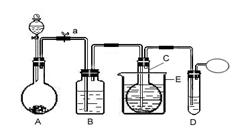
⑴对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是:__________________________________________。 CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示: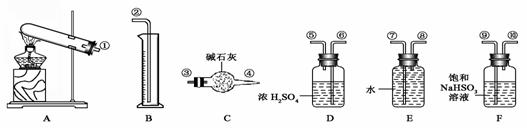
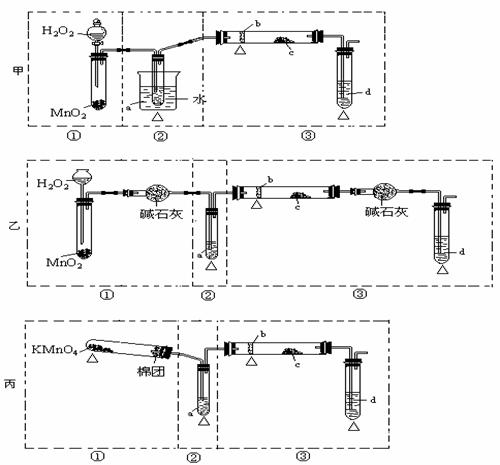
 (I)在75℃左右,实验室用HgSO4做催化剂,可使乙炔与水反应生成乙醛,资料提示HgSO4遇到H2S等物质会发生催化剂中毒而失去活性。
(I)在75℃左右,实验室用HgSO4做催化剂,可使乙炔与水反应生成乙醛,资料提示HgSO4遇到H2S等物质会发生催化剂中毒而失去活性。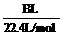 明显小于
明显小于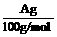 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
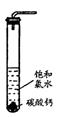 量气泡产生,溶液浅黄绿色褪去;
量气泡产生,溶液浅黄绿色褪去;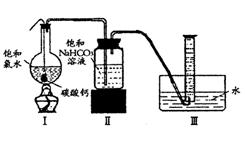 (2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___;
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___;