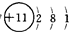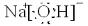摘要:共价键 定义 原子间通过共用电子对所形成的化学键,叫共价键 形成条件 一般是非金属元素之间形成共价键,成键原子具有未成对电子 本质 成键的两原子核与共用电子对的静电作用. 表示方法 1.电子式:H HH 2.结构式 H-Cl H H-N-H 形成过程 H×+.H 分 类 分类依据:共用电子对是否发生偏移 非极性键 定义:共用电子对不偏于任何一方 特定:存在于同种原子之间 A-A单质.共价化合物.离子化合物.离子化合物中都可能含有此键. 例:Cl2.H2O2.Na2O2 极性键 定义:共用电子对偏向成键原子的一方 特点:存在于不同种原子之间 B-A 共价化合物.离子化合物中都可能含有此键 键 参 数 键能 折开1mol共价键所吸收的能量或形成1mol共价键所放出的能量.这个键能就 叫键能. 键能越大.键越牢固.分子越稳定. 键长 两成键原子核之间的平均距离叫键长. 键越短.键能较大.键越牢固.分子越稳定. 键角 分子中相邻的键和键之间的夹角叫键角.它决定分子的空间构型和分子的极性
网址:http://m.1010jiajiao.com/timu3_id_363470[举报]
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)写出⑧的原子核外电子排布式
(2)在这些元素中,化学性质最不活泼的是:
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
 ;
;
(4)用电子式表示元素④和⑥的化合物的形成过程: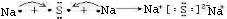
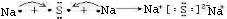 ,此化合物属于
,此化合物属于
(5)表示①与③的化合物的电子式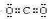
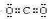 ,该化合物的共价键类型是
,该化合物的共价键类型是
(6)由③和④按原子个数比1:1形成的化合物的电子式是
 ;该化合物的化学键类型是
;该化合物的化学键类型是
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
|||||||
1s22s22p63s23p6
1s22s22p63s23p6
写出⑤的离子核外电子排布式1s22s22p6
1s22s22p6
(2)在这些元素中,化学性质最不活泼的是:
Ar
Ar
(填具体元素符号,下同)(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
HClO4
HClO4
,碱性最强的化合物的电子式是:

(4)用电子式表示元素④和⑥的化合物的形成过程:
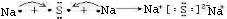
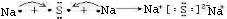
离子
离子
(填“共价”或者“离子”)化合物.(5)表示①与③的化合物的电子式
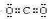
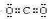
极性共价键
极性共价键
(6)由③和④按原子个数比1:1形成的化合物的电子式是


离子键和共价键
离子键和共价键
.(2010?天津一模)次氯酸盐最大的用途是漂白和消毒.这类漂白剂氧化能力是以“有效氯”的含量来标志.“有效氯”的含量定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示.请问纯LiClO的“有效氯”为( )
查看习题详情和答案>>