12、已知甲、乙溶质质量分数与密度的关系如下表:
|
溶质质量分数 |
甲溶液密度(g/cm3) |
乙溶液密度(g/cm3) |
|
1% |
0.95 |
1.02 |
|
5% |
0.92 |
1.04 |
|
10% |
0.90 |
1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合后,下列叙述正确的是 ( )
A.混合后甲、乙溶液质量分数均大于5%
B.混合后乙溶液质量分数大于5%,甲溶液质量分数小于5%
C.混合后甲溶液质量分数大于5%,乙溶液质量分数小于5%
D.混合后甲、乙溶液质量分数均等于5%
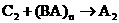 :________________________________
:________________________________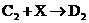 :________________________________
:________________________________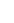 (4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为__________________________。
(4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为__________________________。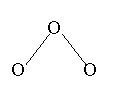 22(11分)、1994年度诺贝尔化学奖授予为研究O3作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图:
22(11分)、1994年度诺贝尔化学奖授予为研究O3作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图:
 3C(g) + D(g)达到平衡时,C的浓度为w mol/L。若维持容器的容积和温度不变,按下列4种情况配比为开始浓度,达到平衡后,C的浓度仍为w mol/L的是
( )
3C(g) + D(g)达到平衡时,C的浓度为w mol/L。若维持容器的容积和温度不变,按下列4种情况配比为开始浓度,达到平衡后,C的浓度仍为w mol/L的是
( )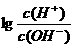 ,则下列叙述正确的是
( )
,则下列叙述正确的是
( ) 可与B2-反应,B2-被氧化,产物为B单质,A2O
可与B2-反应,B2-被氧化,产物为B单质,A2O 的化合物N5AsF6,下列叙述中错误的是
(
)
的化合物N5AsF6,下列叙述中错误的是
(
)