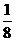26.(10分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
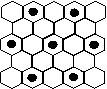
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
25、(12分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 (1)比较下列两组物质的熔点高低(填“>”或“<”
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
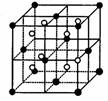
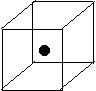
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
该反应的反应热△H = kJ/mol.
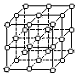 ⑷右图中直线交点处的圆圈为NaCl晶体中Na+离子和Cl-离子所处的位置。请将其中代表Na+离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na+离子周围与它最接近的且距离相等的Na+离子共有 个。
⑷右图中直线交点处的圆圈为NaCl晶体中Na+离子和Cl-离子所处的位置。请将其中代表Na+离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na+离子周围与它最接近的且距离相等的Na+离子共有 个。
24、(12分)下面是四种盐在不同温度下的溶解度(g):
|
温度 |
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.8 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量比为1∶1的NaNO3和KCl为原料,加入一定量的水制取KNO3的实验,其流程如下框图所示。
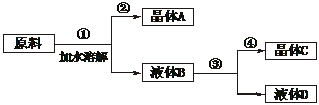
(1)在①和③的实验过程中,关键的实验条件是_________。
(2)分离出晶体的②和④两操作是_______(填倾倒、蒸发、结晶、过滤中的某种操作)。KNO3是晶体_______(A或C)。
(3)粗产品中可能含有的杂质离子是______,检验的方法是_____________________。
(4)将该粗产品提纯,可采取的方法是__________________。