1、 定义:相邻的两个或多个原子之间强烈的相互作用。
定义:相邻的两个或多个原子之间强烈的相互作用。
|
 ①、定义:阴阳离子间通过静电作用所形成的化学键
①、定义:阴阳离子间通过静电作用所形成的化学键
 ②、存在:离子化合物(NaCl、NaOH、Na2O2等);离子晶体。
②、存在:离子化合物(NaCl、NaOH、Na2O2等);离子晶体。
 ①、定义:原子间通过共用电子对所形成的化学键。
①、定义:原子间通过共用电子对所形成的化学键。
|
 共价键
分子、原子、离子晶体。
共价键
分子、原子、离子晶体。
|

|
|
 2、分类
极性键
共价化合物
2、分类
极性键
共价化合物

 化学键
非极性键 非金属单质
化学键
非极性键 非金属单质
|
 ③、分类:
③、分类:
|
 双方提供:共价键
双方提供:共价键

|
金属键:金属阳离子与自由电子之间的相互作用。存在于金属单质、金属晶体中。



|
|
|
|
|
 键能
键能
2003.11
|
化学反应及能量变化
 实质:有电子转移(得失与偏移)
实质:有电子转移(得失与偏移)
特征:反应前后元素的化合价有变化
还原性 化合价升高 弱氧化性
|


 ↑
↑
|

|

 还原剂
氧化反应 氧化产物
还原剂
氧化反应 氧化产物
|

 氧化剂
还原反应
还原产物
氧化剂
还原反应
还原产物

 ↓
↓

 ↓
↓
氧化性 化合价降低 弱还原性
 氧化还原反应:有元素化合价升降的化学反应是氧化还原反应。
氧化还原反应:有元素化合价升降的化学反应是氧化还原反应。
有电子转移(得失或偏移)的反应都是氧化还原反应。
概念: 氧化剂:反应中得到电子(或电子对偏向)的物质(反应中所含元素化合价降低物)
还原剂:反应中失去电子(或电子对偏离)的物质(反应中所含元素化合价升高物)
氧化产物:还原剂被氧化所得生成物;
还原产物:氧化剂被还原所得生成物。
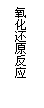 失电子,化合价升高,被氧化
失电子,化合价升高,被氧化
 双线桥:
双线桥:
氧化剂 + 还原剂 = 还原产物 + 氧化产物

得电子,化合价降低,被还原
电子转移表示方法 单线桥: 电子

还原剂 + 氧化剂 = 还原产物 + 氧化产物
 二者的主 表示意义、箭号起止
二者的主 表示意义、箭号起止
要区别: 电子数目等
 依据原则:氧化剂化合价降低总数=还原剂化合价升高总数
依据原则:氧化剂化合价降低总数=还原剂化合价升高总数

 找出价态变化,看两剂分子式,确定升降总数;
找出价态变化,看两剂分子式,确定升降总数;
方法步骤:求最小公倍数,得出两剂系数,观察配平其它。
有关计算:关键是依据氧化剂得电子数与还原剂失电子数相等,列出守恒关系式求解。

 ①、由元素的金属性或非金属性比较;(金属活动性顺序表,元素周期律)
①、由元素的金属性或非金属性比较;(金属活动性顺序表,元素周期律)
 ②、由反应条件的难易比较;
②、由反应条件的难易比较;
③、由氧化还原反应方向比较;(氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物)
④、根据(氧化剂、还原剂)元素的价态与氧化还原性关系比较。
 元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
 ①、活泼的非金属,如Cl2、Br2、O2 等;
①、活泼的非金属,如Cl2、Br2、O2 等;
②、元素(如Mn等)处于高化合价的氧化物,如MnO2、KMnO4等
氧化剂: ③、元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3 等
④、元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3、K2Cr2O7
⑤、过氧化物,如Na2O2、H2O2等。
 ①、活泼的金属,如Na、Al、Zn、Fe 等;
①、活泼的金属,如Na、Al、Zn、Fe 等;
②、元素(如C、S等)处于低化合价的氧化物,如CO、SO2等
还原剂: ③、元素(如Cl、S等)处于低化合价时的酸,如浓HCl、H2S等
④、元素(如S、Fe等)处于低化合价时的盐,如Na2SO3、FeSO4等
⑤、某些非金属单质,如H2 、C、Si等。
 概念:在溶液中(或熔化状态下)有离子参加或生成的反应。
概念:在溶液中(或熔化状态下)有离子参加或生成的反应。
 离子互换反应
离子互换反应
 离子非氧化还原反应 碱性氧化物与酸的反应
离子非氧化还原反应 碱性氧化物与酸的反应
类型: 酸性氧化物与碱的反应
 离子型氧化还原反应 置换反应
离子型氧化还原反应 置换反应
一般离子氧化还原反应
 化学方程式:用参加反应的有关物质的化学式表示化学反应的式子。
化学方程式:用参加反应的有关物质的化学式表示化学反应的式子。
 用实际参加反应的离子符号表示化学反应的式子。
用实际参加反应的离子符号表示化学反应的式子。
表示方法 写:写出反应的化学方程式;
写:写出反应的化学方程式;
离子反应: 拆:把易溶于水、易电离的物质拆写成离子形式;
离子方程式: 书写方法:删:将不参加反应的离子从方程式两端删去;
查:检查方程式两端各元素原子种类、个数、电荷数是否相等。
意义:不仅表示一定物质间的某个反应;还能表示同一类型的反应。
本质:反应物的某些离子浓度的减小。
 金属、非金属、氧化物(Al2O3、SiO2)
金属、非金属、氧化物(Al2O3、SiO2)
 中学常见的难溶物 碱:Mg(OH)2、Al(OH)3、Cu(OH)2、Fe(OH)3
中学常见的难溶物 碱:Mg(OH)2、Al(OH)3、Cu(OH)2、Fe(OH)3
 生成难溶的物质:Cu2++OH-=Cu(OH)2↓ 盐:AgCl、AgBr、AgI、CaCO3、BaCO3
生成难溶的物质:Cu2++OH-=Cu(OH)2↓ 盐:AgCl、AgBr、AgI、CaCO3、BaCO3
生成微溶物的离子反应:2Ag++SO42-=Ag2SO4↓
发生条件 由微溶物生成难溶物:Ca(OH)2+CO32-=CaCO3↓+2OH-
生成难电离的物质:常见的难电离的物质有H2O、CH3COOH、H2CO3、NH3·H2O
生成挥发性的物质:常见易挥发性物质有CO2、SO2、NH3等
发生氧化还原反应:遵循氧化还原反应发生的条件。
 定义:在化学反应过程中放出或吸收的热量;
定义:在化学反应过程中放出或吸收的热量;
符号:△H
单位:一般采用KJ·mol-1
测量:可用量热计测量
研究对象:一定压强下在敞开容器中发生的反应所放出或吸收的热量。
 反应热: 表示方法:放热反应△H<0,用“-”表示;吸热反应△H>0,用“+”表示。
反应热: 表示方法:放热反应△H<0,用“-”表示;吸热反应△H>0,用“+”表示。
燃烧热:在101KPa下,1mol物质完全燃烧生成稳定氧化物时所放出的热量。
 定义:在稀溶液中,酸跟碱发生反应生成1molH2O时的反应热。
定义:在稀溶液中,酸跟碱发生反应生成1molH2O时的反应热。
中和热:强酸和强碱反应的中和热:H+(aq)+OH-(aq)=H2O(l); △H=-57.3KJ·mol-
弱酸弱碱电离要消耗能量,中和热 |△H|<57.3KJ·mol-1
 原理:断键吸热,成键放热。
原理:断键吸热,成键放热。
 反应热的微观解释:反应热=生成物分子形成时释放的总能量-反应物分子断裂时所吸收的总能量
反应热的微观解释:反应热=生成物分子形成时释放的总能量-反应物分子断裂时所吸收的总能量
 定义:表明所放出或吸收热量的化学方程式。
定义:表明所放出或吸收热量的化学方程式。
意义:既表明化学反应中的物质变化,也表明了化学反应中的能量变化。
 热化学
①、要注明反应的温度和压强,若反应是在298K,1atm可不注明;
热化学
①、要注明反应的温度和压强,若反应是在298K,1atm可不注明;
方程式 ②、要注明反应物和生成物的聚集状态或晶型;
书写方法 ③、△H与方程式计量数有关,注意方程式与△H对应,△H以KJ·mol-1单位,化学计量数可以是整数或分数。
④、在所写化学反应方程式后写下△H的“+”或“-”数值和单位,方程式与△H之间用“;”分开。
盖斯定律:一定条件下,某化学反应无论是一步完成还是分几步完成,反应的总热效应相同。

|
分解反应 AB=A+B
 置换反应
A+BC=C+AB
置换反应
A+BC=C+AB
|

 氧化还原反应 概念、特征、本质、分析表示方法、应用
氧化还原反应 概念、特征、本质、分析表示方法、应用

|
 化学反应:
非氧化还原反应
化学反应:
非氧化还原反应
 离子反应
离子反应
 本质、特点、分类、发生的条件
本质、特点、分类、发生的条件


|

 放热反应 热化学反应方程式
放热反应 热化学反应方程式
 吸热反应 燃烧热
吸热反应 燃烧热
中和热
物质的量
 ①、定义:表示含有一定数目粒子的集体。
①、定义:表示含有一定数目粒子的集体。
②、符号:n
 物质的量 ③、单位:摩尔、摩、符号mol
物质的量 ③、单位:摩尔、摩、符号mol
④、1mol任何粒子(分、原、离、电、质、中子)数与0.012kg12C中所含碳原子数相同。
⑤、、架起微观粒子与宏观物质之间联系的桥梁。
 ①、定义:1mol任何粒子的粒子数叫阿伏加德罗常数。
①、定义:1mol任何粒子的粒子数叫阿伏加德罗常数。
阿伏加德罗常数: ②、符号NA
③、近似值:6.02×1023
 ①、定义:单位物质的量气体所占的体积叫~
①、定义:单位物质的量气体所占的体积叫~
 基本概念 气体摩尔体积:②、符号:Vm
基本概念 气体摩尔体积:②、符号:Vm
③、单位:L·mol-1
 ①、定义:单位物质的量物质所具有的质量叫~
①、定义:单位物质的量物质所具有的质量叫~
摩尔质量:②、符号:M ③、单位:g·mol-1或kg·mol-1
④、若以g·mol-1为单位,数值上与该物质相对原子质量或相对分子质量相等。

 ①、定义:单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量叫溶质B的物质的量浓度。
①、定义:单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量叫溶质B的物质的量浓度。
物质的量浓度:②、符号:c(B)
③、单位:mol·L-1
 ①、定律:在相同温度和压强下,相同体积的作何气体都含有相同数目的分子。
①、定律:在相同温度和压强下,相同体积的作何气体都含有相同数目的分子。
 同温同压下:
同温同压下: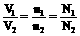
|
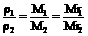
同温同体积下: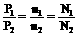
 Ⅰ、气体休的密度和相对密度:
Ⅰ、气体休的密度和相对密度:
标况下: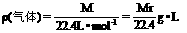
|
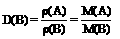
Ⅱ、摩尔质量M(或平均摩尔质量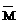 )
)
M=22.4L·mol-1×ρ,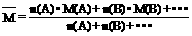
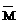 =M(A)ф(A)+M(B)ф(B)+··· ф为体积分数。
=M(A)ф(A)+M(B)ф(B)+··· ф为体积分数。
 ①、以物质的量为中心的有关物理量的换算关系:
①、以物质的量为中心的有关物理量的换算关系:
物质所含粒子数N
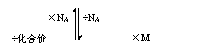
|

|

|
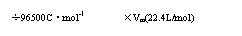
|

|
 电量(C)
气体的体积(标准状况)
电量(C)
气体的体积(标准状况)
|
|

|

|
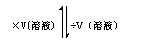
溶液的物质的量浓度CA)
②、物质的量与其它量之间的换算恒等式:
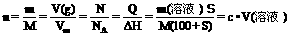
③、理想气体状态方程(克拉伯龙方程):
PV=nRT 或
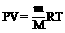 (R=8.314J/mol·K)
(R=8.314J/mol·K)
④
|



 微粒的大小
1mol固、液体的体积
微粒的大小
1mol固、液体的体积
|

 物质体积
微粒的个数
1mol物质的体积
物质体积
微粒的个数
1mol物质的体积
 |
|||
|
|||

 微粒之间距离
1mol气体的体积
微粒之间距离
1mol气体的体积
 ①、溶液稀释定律:溶质的量不变,m(浓)·w(浓)= m(稀)·w(稀);c(浓)·V(浓)=c(稀)·V(稀)
①、溶液稀释定律:溶质的量不变,m(浓)·w(浓)= m(稀)·w(稀);c(浓)·V(浓)=c(稀)·V(稀)
|
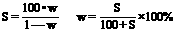
③、溶解度与物质的量浓度的换算: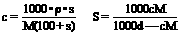
④、质量分数与物质的量浓度的换算: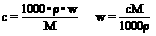
 ⑥、一定物质的量浓度 主要仪器:量筒、托盘天平(砝码)、烧杯、玻璃棒、胶头滴管、容量瓶
⑥、一定物质的量浓度 主要仪器:量筒、托盘天平(砝码)、烧杯、玻璃棒、胶头滴管、容量瓶
溶液的配配制: 方法步骤:计算→称量→溶解→转移→洗涤→振荡→定容→摇匀→装瓶
识差分析:关键看溶质或溶液体积的量的变化。依据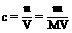 来判断。
来判断。
物质结构 元素周期律

|

 中子N(不带电荷)
同位素 (核素)
中子N(不带电荷)
同位素 (核素)

 原子核
→ 质量数(A=N+Z)
近似相对原子质量
原子核
→ 质量数(A=N+Z)
近似相对原子质量
 质子Z(带正电荷) → 核电荷数
元素 → 元素符号
质子Z(带正电荷) → 核电荷数
元素 → 元素符号



 原子结构 :
最外层电子数决定主族元素的
决定原子呈电中性
原子结构 :
最外层电子数决定主族元素的
决定原子呈电中性
 电子数(Z个):
电子数(Z个):
化学性质及最高正价和族序数
 体积小,运动速率高(近光速),无固定轨道
体积小,运动速率高(近光速),无固定轨道
核外电子 运动特征
|
 电子云(比喻) 小黑点的意义、小黑点密度的意义。
电子云(比喻) 小黑点的意义、小黑点密度的意义。
 排布规律
→ 电子层数
周期序数及原子半径
排布规律
→ 电子层数
周期序数及原子半径
表示方法 → 原子(离子)的电子式、原子结构示意图
 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化:
随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化:
①、原子最外层电子数呈周期性变化
 元素周期律 ②、原子半径呈周期性变化
元素周期律 ②、原子半径呈周期性变化

 ③、元素主要化合价呈周期性变化
③、元素主要化合价呈周期性变化
④、元素的金属性与非金属性呈周期性变化

 ①、按原子序数递增的顺序从左到右排列;
①、按原子序数递增的顺序从左到右排列;
 元素周期律和
排列原则
②、将电子层数相同的元素排成一个横行;
元素周期律和
排列原则
②、将电子层数相同的元素排成一个横行;
元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
 ①、短周期(一、二、三周期)
①、短周期(一、二、三周期)

 周期(7个横行) ②、长周期(四、五、六周期)
周期(7个横行) ②、长周期(四、五、六周期)
周期表结构 ③、不完全周期(第七周期)
 ①、主族(ⅠA-ⅦA共7个)
①、主族(ⅠA-ⅦA共7个)
元素周期表 族(18个纵行) ②、副族(ⅠB-ⅦB共7个)
③、Ⅷ族(8、9、10纵行)
④、零族(稀有气体)
 同周期同主族元素性质的递变规律
同周期同主族元素性质的递变规律
①、核电荷数,电子层结构,最外层电子数
②、原子半径
性质递变 ③、主要化合价
④、金属性与非金属性
⑤、气态氢化物的稳定性
⑥、最高价氧化物的水化物酸碱性
 电子层数: 相同条件下,电子层越多,半径越大。
电子层数: 相同条件下,电子层越多,半径越大。
 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。
判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。
最外层电子数 相同条件下,最外层电子数越多,半径越大。
 微粒半径的比较
1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.
微粒半径的比较
1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.
 定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。其国际单位制(SI)单位为一,符号为1(单位1一般不写)
定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。其国际单位制(SI)单位为一,符号为1(单位1一般不写) 原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。
原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。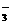 +5I-+6H+====3I2+3H2O
+5I-+6H+====3I2+3H2O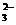 ====2I-+S4O
====2I-+S4O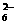
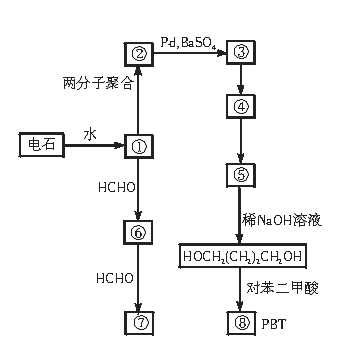
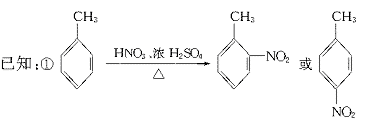
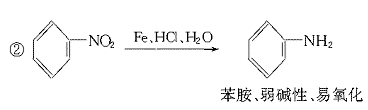
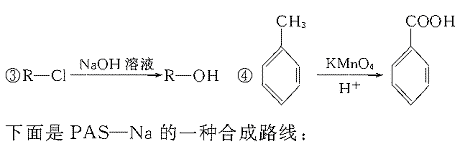
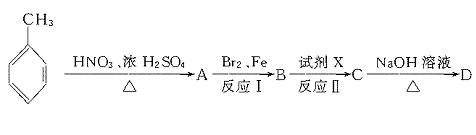
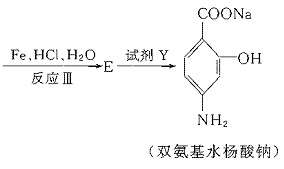
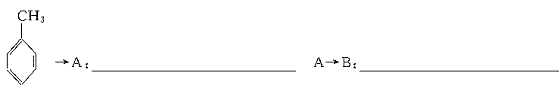
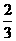 就不再改变 ,已知产物之一为N2O,写出上述变化的化学方程式
。
就不再改变 ,已知产物之一为N2O,写出上述变化的化学方程式
。