摘要:11 高三化学自编复习讲义之二 基础理论 化学反应及能量变化 实质:有电子转移 特征:反应前后元素的化合价有变化 还原性 化合价升高 弱氧化性 变化 ↑ ↑ →产物 反应物→ 还原剂 氧化反应 氧化产物 变化 氧化剂 还原反应 还原产物 ↓ ↓ 氧化性 化合价降低 弱还原性 氧化还原反应:有元素化合价升降的化学反应是氧化还原反应. 有电子转移的反应都是氧化还原反应. 概念: 氧化剂:反应中得到电子的物质(反应中所含元素化合价降低物) 还原剂:反应中失去电子的物质(反应中所含元素化合价升高物) 氧化产物:还原剂被氧化所得生成物, 还原产物:氧化剂被还原所得生成物. 失电子.化合价升高.被氧化 双线桥: 氧化剂 + 还原剂 = 还原产物 + 氧化产物 得电子.化合价降低.被还原 电子转移表示方法 单线桥: 电子 还原剂 + 氧化剂 = 还原产物 + 氧化产物 二者的主 表示意义.箭号起止 要区别: 电子数目等 依据原则:氧化剂化合价降低总数=还原剂化合价升高总数 找出价态变化.看两剂分子式.确定升降总数, 方法步骤:求最小公倍数.得出两剂系数.观察配平其它. 有关计算:关键是依据氧化剂得电子数与还原剂失电子数相等.列出守恒关系式求解. ①.由元素的金属性或非金属性比较,(金属活动性顺序表.元素周期律) ②.由反应条件的难易比较, ③.由氧化还原反应方向比较,(氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物) ④.根据元素的价态与氧化还原性关系比较. 元素处于最高价只有氧化性.最低价只有还原性.处于中间价态既有氧化又有还原性. ①.活泼的非金属.如Cl2.Br2.O2 等, ②.元素处于高化合价的氧化物.如MnO2.KMnO4等 氧化剂: ③.元素处于高化合价时的含氧酸.如浓H2SO4.HNO3 等 ④.元素处于高化合价时的盐.如KMnO4.KClO3.FeCl3.K2Cr2O7 ⑤.过氧化物.如Na2O2.H2O2等. ①.活泼的金属.如Na.Al.Zn.Fe 等, ②.元素处于低化合价的氧化物.如CO.SO2等 还原剂: ③.元素处于低化合价时的酸.如浓HCl.H2S等 ④.元素处于低化合价时的盐.如Na2SO3.FeSO4等 ⑤.某些非金属单质.如H2 .C.Si等. 概念:在溶液中有离子参加或生成的反应. 离子互换反应 离子非氧化还原反应 碱性氧化物与酸的反应 类型: 酸性氧化物与碱的反应 离子型氧化还原反应 置换反应 一般离子氧化还原反应 化学方程式:用参加反应的有关物质的化学式表示化学反应的式子. 用实际参加反应的离子符号表示化学反应的式子. 表示方法 写:写出反应的化学方程式, 离子反应: 拆:把易溶于水.易电离的物质拆写成离子形式, 离子方程式: 书写方法:删:将不参加反应的离子从方程式两端删去, 查:检查方程式两端各元素原子种类.个数.电荷数是否相等. 意义:不仅表示一定物质间的某个反应,还能表示同一类型的反应. 本质:反应物的某些离子浓度的减小. 金属.非金属.氧化物(Al2O3.SiO2) 中学常见的难溶物 碱:Mg(OH)2.Al(OH)3.Cu(OH)2.Fe(OH)3 生成难溶的物质:Cu2++OH-=Cu(OH)2↓ 盐:AgCl.AgBr.AgI.CaCO3.BaCO3 生成微溶物的离子反应:2Ag++SO42-=Ag2SO4↓ 发生条件 由微溶物生成难溶物:Ca(OH)2+CO32-=CaCO3↓+2OH- 生成难电离的物质:常见的难电离的物质有H2O.CH3COOH.H2CO3.NH3·H2O 生成挥发性的物质:常见易挥发性物质有CO2.SO2.NH3等 发生氧化还原反应:遵循氧化还原反应发生的条件. 定义:在化学反应过程中放出或吸收的热量, 符号:△H 单位:一般采用KJ·mol-1 测量:可用量热计测量 研究对象:一定压强下在敞开容器中发生的反应所放出或吸收的热量. 反应热: 表示方法:放热反应△H<0.用“- 表示,吸热反应△H>0.用“+ 表示. 燃烧热:在101KPa下.1mol物质完全燃烧生成稳定氧化物时所放出的热量. 定义:在稀溶液中.酸跟碱发生反应生成1molH2O时的反应热. 中和热:强酸和强碱反应的中和热:H+(aq)+OH-(aq)=H2O(l); △H=-57.3KJ·mol- 弱酸弱碱电离要消耗能量.中和热 |△H|<57.3KJ·mol-1 原理:断键吸热.成键放热. 反应热的微观解释:反应热=生成物分子形成时释放的总能量-反应物分子断裂时所吸收的总能量 定义:表明所放出或吸收热量的化学方程式. 意义:既表明化学反应中的物质变化.也表明了化学反应中的能量变化. 热化学 ①.要注明反应的温度和压强.若反应是在298K.1atm可不注明, 方程式 ②.要注明反应物和生成物的聚集状态或晶型, 书写方法 ③.△H与方程式计量数有关.注意方程式与△H对应.△H以KJ·mol-1单位.化学计量数可以是整数或分数. ④.在所写化学反应方程式后写下△H的“+ 或“- 数值和单位.方程式与△H之间用“, 分开. 盖斯定律:一定条件下.某化学反应无论是一步完成还是分几步完成.反应的总热效应相同. 按物质类别 和种数分类 化合反应 A+B=AB 分解反应 AB=A+B 置换反应 A+BC=C+AB 按化合价有无变化分类 和种数分类 复分解反 AB+CD=AC+BD 氧化还原反应 概念.特征.本质.分析表示方法.应用 按实际反应的微粒分类 和种数分类 化学反应: 非氧化还原反应 离子反应本质.特点.分类.发生的条件 按反应中的 能量变化分 分子反应 反应热与物质能量的关系 放热反应 热化学反应方程式 吸热反应 燃烧热 中和热 物质的量 ①.定义:表示含有一定数目粒子的集体. ②.符号:n 物质的量 ③.单位:摩尔.摩.符号mol ④.1mol任何粒子数与0.012kg12C中所含碳原子数相同. ⑤..架起微观粒子与宏观物质之间联系的桥梁. ①.定义:1mol任何粒子的粒子数叫阿伏加德罗常数. 阿伏加德罗常数: ②.符号NA ③.近似值:6.02×1023 ①.定义:单位物质的量气体所占的体积叫~ 基本概念 气体摩尔体积:②.符号:Vm ③.单位:L·mol-1 ①.定义:单位物质的量物质所具有的质量叫~ 摩尔质量:②.符号:M ③.单位:g·mol-1或kg·mol-1 ④.若以g·mol-1为单位.数值上与该物质相对原子质量或相对分子质量相等. ①.定义:单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量叫溶质B的物质的量浓度. 物质的量浓度:②.符号:c(B) ③.单位:mol·L-1 ①.定律:在相同温度和压强下.相同体积的作何气体都含有相同数目的分子. 同温同压下: 阿伏加德 罗定律及 其推论: ②.推论: 同温同压下: 同温同体积下: Ⅰ.气体休的密度和相对密度: 标况下: ③.运用: A气体对B气体的相对密度: Ⅱ.摩尔质量M(或平均摩尔质量) M=22.4L·mol-1×ρ. =M+··· ф为体积分数. ①.以物质的量为中心的有关物理量的换算关系: 物质所含粒子数N ÷M ×化合价 物质的量n 电解质电离出离子的“物质的量 物质的质量(m) ×96500C·mol-1 ÷Vm 电量(C) 气体的体积 ×Vm ×△H ÷Vm ÷△H V气体体积 反应中放出或吸收的热量(KJ)Q 溶液的物质的量浓度CA) ②.物质的量与其它量之间的换算恒等式: ③.理想气体状态方程: PV=nRT 或 ④ 决定于 .影响物质体积大小的因素: 微粒的大小 1mol固.液体的体积 决定于 物质体积 微粒的个数 1mol物质的体积 决定于 微粒之间距离 1mol气体的体积 ①.溶液稀释定律:溶质的量不变.m·w=c ⑤.溶液浓度换算式: ②.溶解度与溶质质量分数w换算式: ③.溶解度与物质的量浓度的换算: ④.质量分数与物质的量浓度的换算: ⑥.一定物质的量浓度 主要仪器:量筒.托盘天平.烧杯.玻璃棒.胶头滴管.容量瓶 溶液的配配制: 方法步骤:计算→称量→溶解→转移→洗涤→振荡→定容→摇匀→装瓶 识差分析:关键看溶质或溶液体积的量的变化.依据来判断. 物质结构 元素周期律 决定原子种类 中子N 同位素 原子核 → 质量数 近似相对原子质量 质子Z → 核电荷数 元素 → 元素符号 原子结构 : 最外层电子数决定主族元素的 决定原子呈电中性 电子数(Z个): 化学性质及最高正价和族序数 体积小.运动速率高.无固定轨道 核外电子 运动特征 决定 电子云 小黑点的意义.小黑点密度的意义. 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子的电子式.原子结构示意图 随着原子序数的递增:元素的性质呈现周期性变化: ①.原子最外层电子数呈周期性变化 元素周期律 ②.原子半径呈周期性变化 ③.元素主要化合价呈周期性变化 ④.元素的金属性与非金属性呈周期性变化 ①.按原子序数递增的顺序从左到右排列, 元素周期律和 排列原则 ②.将电子层数相同的元素排成一个横行, 元素周期表 ③.把最外层电子数相同的元素排成一个纵行. ①.短周期 周期 ②.长周期 周期表结构 ③.不完全周期 ①.主族 元素周期表 族 ②.副族 ③.Ⅷ族 ④.零族 同周期同主族元素性质的递变规律 ①.核电荷数.电子层结构.最外层电子数 ②.原子半径 性质递变 ③.主要化合价 ④.金属性与非金属性 ⑤.气态氢化物的稳定性 ⑥.最高价氧化物的水化物酸碱性 电子层数: 相同条件下.电子层越多.半径越大. 判断的依据 核电荷数 相同条件下.核电荷数越多.半径越小. 最外层电子数 相同条件下.最外层电子数越多.半径越大. 微粒半径的比较 1.同周期元素的原子半径随核电荷数的增大而减小如:Na>Mg>Al>Si>P>S>Cl.
网址:http://m.1010jiajiao.com/timu3_id_356196[举报]
(2012?宜春模拟)温度为T时,向4L恒容密闭容器中充入2.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g),经一段时间后达到平衡.反应过程中测定的部分数据见下表.
|
查看习题详情和答案>>
(2011?顺义区二模)甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护.请回答下列问题:(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染.已知:
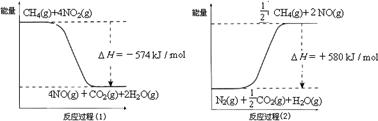
反应过程(2)是
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
①此反应在110℃时平衡常数为
③判断该反应的正反应是
④为提高实验3中CCl4的转化率,可采取的措施是
a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.
查看习题详情和答案>>

反应过程(2)是
吸热
吸热
反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734kJ/mol
2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734kJ/mol
.(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
| 实验 序号 |
温度℃ | 初始n(CCl4) (mol) |
初始n(H2) (mol) |
平衡时n(CHCl3) (mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
1
1
. ②实验l中,CCl4的转化率为60%
60%
.③判断该反应的正反应是
放热
放热
(填“放热”或“吸热”),理由是温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应
温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应
.④为提高实验3中CCl4的转化率,可采取的措施是
e
e
.a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.