摘要:同一元素不同价态的微粒半径.价态越高离子半径越小.如Fe>Fe2+>Fe3+ ①与水反应置换氢的难易 ②最高价氧化物的水化物碱性强弱 金属性强弱 ③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后) ④互相置换反应 依据: ⑤原电池反应中正负极 ①与H2化合的难易及氢化物的稳定性 元素的 非金属性强弱 ②最高价氧化物的水化物酸性强弱 金属性或非金属 ③单质的氧化性或离子的还原性 性强弱的判断 ④互相置换反应 ①.同周期元素的金属性.随荷电荷数的增加而减小.如:Na>Mg>Al;非金属性.随荷电荷数的增加而增大.如:Si<P<S<Cl. 规律: ②.同主族元素的金属性.随荷电荷数的增加而增大.如:Li<Na<K<Rb<Cs;非金属性.随荷电荷数的增加而减小.如:F>Cl>Br>I. ③.金属活动性顺序表:K>Ca>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au 定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准.其它原子的质量跟它比较所得的值.其国际单位制(SI)单位为一.符号为1 原子质量:指原子的真实质量.也称绝对质量.是通过精密的实验测得的. 如:一个Cl2分子的m(Cl2)=2.657×10-26kg. 核素的相对原子质量:各核素的质量与12C的质量的1/12的比值.一种元素有几种同位素.就应有几种不同的核素的相对原子质量. 相对原子质量 诸量比较: 如35Cl为34.969,37Cl为36.966. 核素的近似相对原子质量:是对核素的相对原子质量取近似整数值.数值上与该核素的质量数相等.如:35Cl为35,37Cl为37. 元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值.如:Ar(Cl)=Ar(35Cl)×a% + Ar(37Cl)×b% 元素的近似相对原子质量:用元素同位素的质量数代替同位素相对原子质量与其丰度的乘积之和. 注意: ①.核素相对原子质量不是元素的相对原子质量. ②.通常可以用元素近似相对原子质量代替元素相对原子质量进行必要的计算. 定义:核电荷数相同.中子数不同的核素.互称为同位素.(即:同种元素的不同原子或核素) 同位素 ①.结构上.质子数相同而中子数不同, 特点: ②.性质上.化学性质几乎完全相同.只是某些物理性质略有不同, ③.存在上.在天然存在的某种元素里.不论是游离态还是化合态.同位素的原子百分含量一般是不变的.
网址:http://m.1010jiajiao.com/timu3_id_356199[举报]
下列说法中正确的是()
- A.构成单质分子的微粒一定含有共价键
- B.失电子难的原子获得电子的能力一定强
- C.在化学反应中,某元素由化合态变为游离态,该元素被还原
- D.电子层结构相同的不同离子,其半径随核电荷数增多而减小
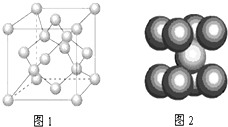 A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:
A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:(1)C与A形成的最简单分子是
(2 )在由A、B两元素形成的一系列化合物中,若要求所有的原子都有可能在同一个平面中,则对B原子成键轨道的要求是
(3)一定条件下,元素B可形成多种同素异形体,它们有的属原子晶体、有的属分子晶体、有的属混合型晶体,如图1是其中某种晶体的一个晶胞,该晶胞中含有
(4)如图2为晶体D的晶胞结构,若D原子的半径为r cm,NA为阿伏加德罗常数的值,则晶体D的密度为
(2009?山东)(化学-物质结构与性质)C和Si元素在化学中占有极其重要的地位.
(1)写出Si的基态原子核外电子排布式
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,则M为
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键
查看习题详情和答案>>
(1)写出Si的基态原子核外电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为
O>C>Si
O>C>Si
.(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
sp3
sp3
,微粒间存在的作用力是共价键
共价键
.(3)氧化物MO的电子总数与SiC的相等,则M为
Mg
Mg
(填元素符号).MO是优良的耐高温材料,其晶体结构与NaCl晶体相似.MO的熔点比CaO的高,其原因是Mg2+半径比Ca2+小,MgO晶格能大
Mg2+半径比Ca2+小,MgO晶格能大
.(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键
Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
.(2008?闵行区模拟)A、B、C、D是四种短周期元素,它们的相关信息如下表:
(1)表中所述A的单质晶体中微粒间的相互作用有
(2)B元素原子核外最外层电子的轨道表示式为
 ,其最高价氧化物对应水化物的化学特性是
,其最高价氧化物对应水化物的化学特性是
(3)C元素的氢化物的分子为
(4)与D同主族的短周期元素,其单质及其化合物与D的单质及化合物均具有的性质为
A.一定条件下其单质易与活泼金属反应 B.气态氢化物极易溶于水并呈强酸性
C.气态氢化物具有很好的热稳定性 D.常温下单质跟水剧烈反应并放出氧气.
查看习题详情和答案>>
| 元素 | 元素性质及相关信息 |
| A | 其单质的一种晶体虽不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可作高温轴承的润滑剂、火箭发动机喷管和电极材料. |
| B | 其单质能与强酸、强碱溶液反应,其离子在第三周期单核阳离子中半径最小. |
| C | 是蛋白质的组成元素之一,原子核外有3种不同能量的电子,且未成对电子数最多. |
| D | 原子核外最外层电子排布为nsnnp2n+1. |
共价键
共价键
、范德华力
范德华力
.(2)B元素原子核外最外层电子的轨道表示式为


两性氢氧化物(即能与酸反应,又能与碱反应)
两性氢氧化物(即能与酸反应,又能与碱反应)
.(3)C元素的氢化物的分子为
极性
极性
(填“极性“或”非极性“)分子,其溶于水后溶液呈碱性的原因是NH3+H2O NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH-
 NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH-NH3+H2O NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH-
(用方程式表示). NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH-(4)与D同主族的短周期元素,其单质及其化合物与D的单质及化合物均具有的性质为
A、C
A、C
(填序号).A.一定条件下其单质易与活泼金属反应 B.气态氢化物极易溶于水并呈强酸性
C.气态氢化物具有很好的热稳定性 D.常温下单质跟水剧烈反应并放出氧气.
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题:(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)RQ4Y分子的某中心原子采用的杂化轨道类型是
sp3
sp3
杂化.(2)R、X、Y三种元素的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与RY分子互为等电子体的分子和离子分别为
N2
N2
和CN-
CN-
(填化学式).(4)Z元素位于周期表的
d
d
分区.Z原子基态时的外围电子排布式为3d24s2
3d24s2
,Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个“Z”原子等距离且最近的氧原子数为6
6
.