网址:http://m.1010jiajiao.com/timu3_id_351184[举报]
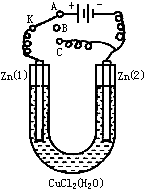 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:(1)如果把电键K接A,这一装置形成
(2)上述反应进行5min后,转换电键K到C,这一装置形成
(3)上述装置进行2min后,再转换电键K到B,在Zn(2)极上发生的腐蚀属于
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值
(2)醋酸钠水解的离子方程式为
(3)0.5mol?L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol?L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)
(6)若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL.混合而得,则下列说法不正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol?L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol?L-1.向其中加入固体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol?L-1,(不考虑溶液体积变化)以上三种金属离子中
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL 0.5mol?L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)=
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
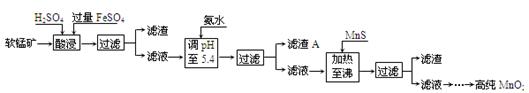
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中总反应式:Zn+2MnO2+2H2O = 2MnOOH+Zn(OH)2
MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写出两种)。
查看习题详情和答案>>(11分)(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有 和 。
(2)锌与盐酸反应速率可以通过观察 进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是 或 。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________。
③试分析1~3min时间段里,反应速率变大的主要原因 。 查看习题详情和答案>>
A.Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s);ΔH=-216 kJ·mol-1, E反应物<E生成物
B.CaCO3(s)====CaO(s)+CO2(g);ΔH=+178.5 kJ·mol-1, E生成物<E反应物
C.HI(g) ====![]() H2(g)+
H2(g)+![]() I2(s);ΔH=-26.5 kJ·mol-1,1 mol HI在密闭容器中分解达平衡后放出26.5 kJ的能量
I2(s);ΔH=-26.5 kJ·mol-1,1 mol HI在密闭容器中分解达平衡后放出26.5 kJ的能量
D.H+(aq)+OH-(aq) ====H2O(l);ΔH=-57.2 kJ·mol-1,含1 L 1mol·L-1的NaOH溶液与含0.5 mol H2SO4的浓硫酸混合后放热57.2 kJ
查看习题详情和答案>>