1.意大利科学家使用普通氧分子和特殊的氧离子作用,制造出新型的氧分子O4,它的结构很复杂。下列有关O4的说法不正确的是 ( )
A、O4与O2、O3都是氧的同素异形体 B、合成O4的反应可看作核聚变反应
C、O4分子存在非极性共价键 D、O4的密度比普通氧分子大
2.下列有机物中,既显酸性,又能发生酯化反应和消去反应的是( )
A、CH3- -CH2OH B、HO-CO-CH(OH)-COOH
-CH2OH B、HO-CO-CH(OH)-COOH
C、CH3-CH=CH-COOH D、CH3-CH2-C(OH)H-COOH
3.当不慎有大量氯气逸出到周围空间时,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子,该物质最适宜采用的是 ( )
A.NaOH B.NaCl C.KBr D.Na2CO3
4.氯胺H2NCl是常用的消毒杀菌剂,主要因为它能水解产生具有显著氧化性的物质,其水解的两种产物应是 ①NH4Cl②HCl③NH4ClO④NH3⑤HClO中的 ( )
A.①② B.②③ C.④⑤ D.③④
5.1 mol某气态烃能和2 mol HCl加成,其加成产物又可被6molCl2完全取代,该烃可能为( )
A.丙炔 B.丁炔 C.乙炔 D.1,3一丁二烯
6.下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是 ①金属钠在纯氧中燃烧②FeSO4溶液中滴入NaOH溶液,并在空气由放置一段时间③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中 ( )
A.②③①④ B.③②①④ C.③①②④ D.①②③④
7.CaC2和 MgC2都是离子化合物,下列叙述中正确的是 ( )
A.MgC2和 CaC2都能跟水反应生成乙炔
B.C22-的电子式为[C:: C]2-
C.CaC2在水中以 Ca2+和 C22一形式存在
D. MgC2的熔点低,可能在 100℃以下
8.硼有两种天然同位素510B和511B,硼元素的相对原子质量为10.80,则硼元素中510B质量分数约为 ( )
A.20% B.80% C.18.5% D.21.5%
9.下列各分子中,所有原子都满足最外层为8电子结构的是
A H2O B BF3 C CCl4 D PCl5
10. 23.24毫升浓度为0.05摩/升的Na2SO3溶液,恰好与20毫升浓度为0.02摩/升的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
A.+6 B.+3 C.+2 D.0
11.能说明BF3分子的4个原子在同一平面中的理由是 ( )
A.B-F键为非极性键 B. 任意两个B-F键之间的键角为120”
C.三个B-F键的键能相同 D. 三个B-F键的键长相等
12.钛被誉为“未来钢铁”、“太空金属”,原因是它的强度大,密度小,抗腐性能好,室温下,它不与水、稀盐酸、稀H2SO4、稀HNO3作用,但易溶于氢氟酸,推测其原因是( ) A.氢氟酸的酸性比其它酸强 B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强 D.钛离子易与氟离子形成可溶性难电离物质 13.已知甲、乙溶质质量分数与密度的关系如下表:
|
溶质质量分数 |
甲溶液密度(g/cm3) |
乙溶液密度(g/cm3) |
|
1% |
0.95 |
1.02 |
|
5% |
0.92 |
1.04 |
|
10% |
0.90 |
1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合后,下列叙述正确的是
A.混合后甲、乙溶液质量分数均大于5%
B.混合后乙溶液质量分数大于5%,甲溶液质量分数小于5%
C.混合后甲溶液质量分数大于5%,乙溶液质量分数小于5%
D.混合后甲、乙溶液质量分数均等于5%
14.水的电离过程为H2O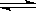 H++OH-,在不同温度下其离子积常数为:
H++OH-,在不同温度下其离子积常数为:
(25℃) KW =1.0×10-14,(35℃) KW =2.1×10-14。则下列叙述正确的是 ( )
A. c(H+)随着温度升高而降低 B在35℃时,c(H+)>c(OH-)
C 水的电离程度?(25℃)>?(35℃)D 水的电离是吸热的
15.有机物分子中原子间(或原子团间)的相互影响会导致物质化学性质的不同。下列各项事实不能说明上述观点的是:
A. 甲苯能使酸性高锰酸钾溶液褪色,而苯不能
B. 乙烯能发生加成反应而乙烷不能
C. 苯酚能和氢氧化钠溶液反应而乙醇不能
D丙酮(CH3COCH3)分子中的氢比乙烷分子中的氢更容易被卤原子取代
16、按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是 ( )
A.E表示生成铜的物质的量 B.E表示反应消耗水的物质的量
C.F表示生成硫酸的物质的量 D.F表示反应生成氧气的物质的量
17.近年查明,二氧化三碳(C3O2)是金星大气层的一个组成部分,下列关于二氧化三碳的说法中错误的是( )
A.结构简式是 O=C=C=C=O B.C3O2、CO、CO2都是碳的氧化物
C.C3O2与CO都可以燃烧生成CO2 D. C3O2与CO2都是碳酸的酸酐
18.三氟化氮(NF3)是无色无味的气体,它可由氨气和氟气反应得到:
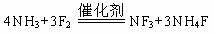
下列有关NF3的叙述正确的是( )
A、NF3的氧化性比F2强 B、NF3是离子化合物
C、NF3中N呈-3价 D、NF3分子呈三角锥形
第Ⅱ卷(非选择题)
19.把淀粉和NaBr溶液装入半透膜袋,多次浸入蒸馏水中进行分离。请问:
(1)该分离方法称为 。
(2)怎样证明淀粉未透过半透膜而Br-已经透过半透膜?(仪器、试剂任用)
(3)怎样证明淀粉与NaBr已经分离完全?(仪器、试剂任用)
20.(14分)有四支干燥的小试管中,分别装有少量白色物质(约占试管容积的1/10),已知该白色物质肯定是碳酸氢铵、碳酸氢钠、碳酸钠或氯化钠中的一种,现通过加热试管中样品和使用蒸馏水、石蕊试液或pH试纸进行鉴定。
(1) 该实验的步骤怎样?
(2)请思考并填写下表:
|
白色物质 |
判断依据 |
有关化学方程式(或离子方程式) |
|
碳酸氢铵 |
|
|
|
碳酸氢钠 |
|
|
|
碳酸钠 |
|
|
|
氯化钠 |
|
|
21.某可逆反应为A(气)+B(气) 3C(气),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数(φ)与反应时间(t)的关系。
3C(气),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数(φ)与反应时间(t)的关系。
(1)若甲图中的a、b两条曲线分别表示有催化剂和无催化剂的情况,则曲线 表示的是无催化剂时的情况(催化剂一般是指正催化剂)。
(2)若乙图中的两条曲线分别表示在100℃和200℃时的情况,则可逆反应的正反应是
(选填吸热、放热)反应。
(3)若丙图中的a、b两条曲线分别表示在不同压强时的情况 ,则曲线 表示的是压强较大时的情况。
22.三聚氰酸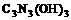 可用于消除汽车尾气中的氮氧化物(如
可用于消除汽车尾气中的氮氧化物(如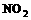 )。当加热至一定温度时,它发生如下分解:
)。当加热至一定温度时,它发生如下分解: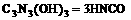 (
( 异氰酸,其结构是H–N=C=O)能和
异氰酸,其结构是H–N=C=O)能和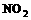 反应生成
反应生成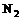 、
、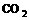 和
和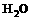 。
。
(1) 写出 和
和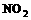 反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
(2)如按上述反应式进行反应,试计算吸收 气体所消耗的三聚氰酸的质量?
气体所消耗的三聚氰酸的质量?
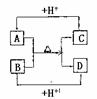 23. A、B、C、D分别是由两种短周期元素组成的常见微粒,这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:
23. A、B、C、D分别是由两种短周期元素组成的常见微粒,这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:
(1)A、D的电子式分别为:A____________,D_______________。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别 代表B、C、D中的某一种微粒),则x、y、z分别代表的微粒符号为 x________,y__________,z________
(3)请分别用离子方程式说明结合质子能力x>y>z的判断依据:
x>y:___________________________________________
y>z:___________________________________________
24.将盛有 a molNO2和 b mol NO混合气体的试管倒立于水槽中,再通入 b mol O2,充分反应后试管里剩余的成分及物质的量决定于a与b的关系,请填写下列表格。
|
Aa与b的关系 |
剩余气体成分 |
剩余气体物质的量 |
|
若a=b |
|
|
|
|
|
(a-b)/3 |
|
|
剩余O2 |
|
25. 等物质的量的NaHCO3和KHCO3的混合物9.20g与l00 mL盐酸反应。
(l)试分析,欲求标准状况下生成的 CO2的体积时,还需什么数据(用a、b等表示,要注明单位)。
(2)求标准状况下生成的CO2的体积:
|
|
所需数据的取值范围 |
生成CO2的体积(标准状况) |
|
盐酸不足时 |
|
|
|
盐酸过量时 |
|
|
(3)若NaHCO3和KHCO3不是等物质的量混合,则9.20g固体与盐酸完全反应时,在标准状况下生成CO2气体的体积大于_________L,小于____________L。
26.有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z。已知X是由a和b元素按原子个数比为1:1组成的化合物。
 Na2SO3+S↓。通常配制标准硫代硫酸钠溶液时,为防止变质,需用煮沸后经冷却的蒸馏水,还需加入少量的碳酸钠和少量的另一种试剂是
( )
Na2SO3+S↓。通常配制标准硫代硫酸钠溶液时,为防止变质,需用煮沸后经冷却的蒸馏水,还需加入少量的碳酸钠和少量的另一种试剂是
( ) 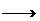 Y
②a+c
Y
②a+c 请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。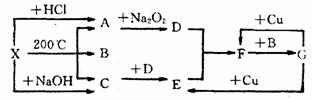 右图表示的反应关系中,部分产物被略去,
X为l mol固体,A、B、C各为l rnol无色气体,
右图表示的反应关系中,部分产物被略去,
X为l mol固体,A、B、C各为l rnol无色气体,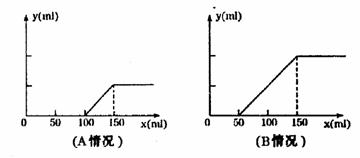 分别取等物质的量浓度的氢氧化钠溶液各100ml,再通入一定量的CO2,随后分别各取20mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A.B两种情况):
分别取等物质的量浓度的氢氧化钠溶液各100ml,再通入一定量的CO2,随后分别各取20mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A.B两种情况):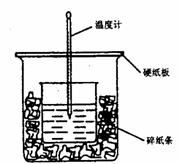 50ml 0.5mol·L-1的盐酸与50ml0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
50ml 0.5mol·L-1的盐酸与50ml0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题: