25、铅蓄电池在作电源时,用硫酸作为电解质溶液。电池放电时反应如下:Pb+PbO2+2H2SO4==2PbSO4+2H2O。下表是不同质量分数的硫酸对应的密度。
|
质量分数 |
0.220 |
0.252 |
0.283 |
0.314 |
0.344 |
0.374 |
0.403 |
|
密度(g/mL) |
1.155 |
1.180 |
1.205 |
1.230 |
1.255 |
1.280 |
1.305 |
回答下列问题:
(1)写出电池放电时正极的电极反应式:__________________________。
(2)已知铅蓄电池中硫酸溶液的密度低于1.18 g/mL时,将不再放电,此时需要充电;充电过程中,当密度达到1.28 g/mL时,电池自行停止充电。现有某经充分充电后的铅蓄电池(设铅蓄电池的容积为2L,且在充、放电过程中液体体积保持不变),现让该电池充分放电,理论上将释放出多少的电量(以电子数目表示)?
20、最近报纸上经常刊载有关建筑工人误食亚硝酸钠(由于亚硝酸钠很象氯化钠而误作食盐)中毒的事件,某课外兴趣小组决定开展研究,寻求可行的方法,鉴别某样品是亚硝酸钠还是氯化钠,以解决这一问题。该小组查阅了大量的资料,对亚硝酸钠的性质做如下归纳:
亚硝酸钠,化学式为NaNO2,是亚硝酸(HNO2,一种弱酸)的钠盐。白色粉末,易溶解在水中,有毒,容易潮解。由于亚硝酸钠中的氮元素处于中间价态,既有氧化性(在酸性条件下会氧化KI,得到碘单质),又有还原性(在酸性条件下,会被KMnO4氧化)。大量用于防锈、印染等……
甲设计方案如下:取少量固体,配成溶液。往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色。如果褪去,说明该样品为亚硝酸钠。反应表达式为:
___MnO4-+___NO2-+___H+=___Mn2++___NO3-+___H2O
(1)配平上述离子方程式;
(2)根据上述信息,还可以设计其他一些实验方案。试写出你所设计的方案(注:能写几种写几种;用品自行选择;简要写出实验操作、现象和结论。)
(3)甲认为他的方案还可测定样品中亚硝酸钠的含量。过程如下:Ⅰ、称一定量样品,溶于水置于锥形瓶中;Ⅱ、取酸性KMnO4溶液(过量)倒入锥形瓶中,振荡;Ⅲ、用草酸钠溶液滴定过量的KMnO4;Ⅳ、重复上述操作。
①若每次实验时用到0.10mol/L酸性KMnO4溶液25.00mL,为减小实验误差,从中学的角度看,量取该溶液时宜采用的仪器是______________________。
②各次实验数据如下:
|
实验次序 |
样品质量(g) |
滴定管中的草酸钠溶液(浓度为0.25mol/L) |
|
|
滴定前滴定管读数(mL) |
滴定后滴定管读数(mL) |
||
|
1 |
5.0 |
1.02 |
10.02 |
|
2 |
5.0 |
1.56 |
10.60 |
|
3 |
5.0 |
1.26 |
10.24 |
已知:2MnO4-+5C2O42-+16H+==2Mn2++10CO2↑+8H2O。试计算样品中NaNO2的质量分数(必须列出计算过程;假设该样品只含有NaNO3和NaNO2)。
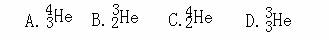



 2B(g)+C(g),2D(g)+C(g)
2B(g)+C(g),2D(g)+C(g)  2E(g)
2E(g) zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( )
zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( )