16.(10分)由化学能产生的能量是目前人类使用的主要能源。回答下列问题:
⑴ N2和O2在一定条件下反应生成NO2的热化学方程式为:
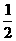 N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
⑵ 化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
|
化学键 |
键能(kJ/mol) |
化学键 |
键能(kJ/mol) |
|
N≡N |
942 |
H-O |
460 |
|
N-H |
391 |
O=O |
499 |
|
H-H |
437 |
|
|
① 写出N2和H2反应合成氨的热化学方程式 。
② 已知:1molH2O(g)转化为1molH2O(l)时放出44.0 kJ的热量。计算1g H2完全燃烧时放出的热量
。H2O(g)的稳定性 (“大于”、“小于”)H2O(l)。
⑶ 写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式 。
15.(12分)乙酸乙酯是重要的有机合成中间体,广泛应用于
化学工业。为证明浓硫酸在实验室制备乙酸乙酯反应中起
催化剂和吸水剂的作用,某同学利用右图所示装置进行了
以下四个实验,实验开始先用酒精灯微热3min,再加热使
之微微沸腾3min。实验结束后充分振荡试管2,再测有机
层的厚度,实验记录如下:
|
实验 编号 |
试管1中的试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
|
A |
2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 |
饱和碳酸钠 溶液 |
5.0 |
|
B |
3mL乙醇、2mL乙酸 |
0.1 |
|
|
C |
3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 |
1.2 |
|
|
D |
3mL乙醇、2mL乙酸、盐酸 |
1.2 |
(1) 如果用CH3COOH和C2H518OH进行反应制备乙酸乙酯,写出反应的化学方程式:
________ ____________________。
(2)干燥管在上述实验中的作用_________ ________________________。
(3) 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol/L。
(4)分析实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 。
(5)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低, 可能的原因是 、 。

 高二化学第一学期期中考试(实验班)
高二化学第一学期期中考试(实验班)
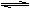 Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。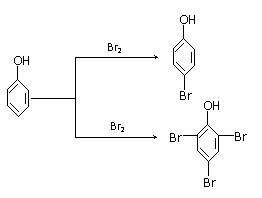 ⑵ 事实证明,苯酚的卤代反应与反应环境有关,在酸性环境中生成一元取代物,在碱性环境中生成三元取代物(如下)。可能的原因是
;
⑵ 事实证明,苯酚的卤代反应与反应环境有关,在酸性环境中生成一元取代物,在碱性环境中生成三元取代物(如下)。可能的原因是
;