16.(10分)由化学能产生的能量是目前人类使用的主要能源。回答下列问题:
⑴ N2和O2在一定条件下反应生成NO2的热化学方程式为:
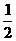 N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
⑵ 化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
|
化学键 |
键能(kJ/mol) |
化学键 |
键能(kJ/mol) |
|
N≡N |
942 |
H-O |
460 |
|
N-H |
391 |
O=O |
499 |
|
H-H |
437 |
|
|
① 写出N2和H2反应合成氨的热化学方程式 。
② 已知:1molH2O(g)转化为1molH2O(l)时放出44.0 kJ的热量。计算1g H2完全燃烧时放出的热量 。H2O(g)的稳定性 (“大于”、“小于”)H2O(l)。
⑶ 写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式 。
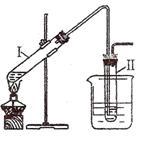
15.(11分)实验室用右图所示的装置制取溴乙烷。在试管I中依次
加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠
粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管
I至微沸状态数分钟后,冷却。
试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 (任写两种结构简式)。
(3)设计实验证明试管Ⅱ收集的溴乙烷中含有溴元素,完成以下实验报告:
|
实验步骤 |
实验操作 |
现象及结论 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
(4)请写出(3)中涉及的所有方程式。

 江苏省扬中高级中学2008- -2009学年度第一学期高二期中考试(普通班)
江苏省扬中高级中学2008- -2009学年度第一学期高二期中考试(普通班)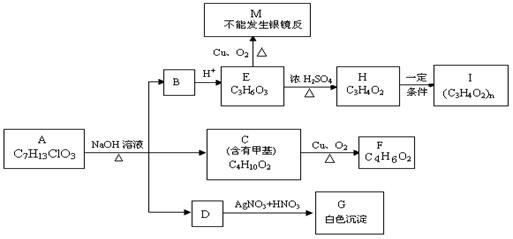

 2PbSO4+2H2O
2PbSO4+2H2O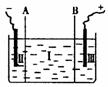 ③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、 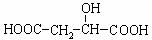
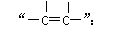
 非
选 择 题(共72分)
非
选 择 题(共72分)