27.50 ml-25.90 mL=1.60 mL.
在用滴定管测量液体体积的实际操作中必然要先后两次进行读数,常称其为“初读”和“末读”.
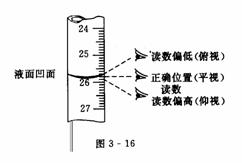
配制一定物质的量浓度的溶液所需液体溶质的体积为既定值,如需要量取某硫酸溶液4.80mL,6.70 mL等.在这里,对于用滴定管量取一定体积的液体,仅就初读和末读引起的液体体积误差的判断方法,用下表和图3-16所示形式说明.
|
读数类型及方式 |
液体体积 |
||
|
末读平视 |
初读 |
仰视 |
偏小 |
|
俯视 |
偏大 |
||
|
初读平视 |
末读 |
仰视 |
偏大 |
|
俯视 |
偏小 |
思维拓展
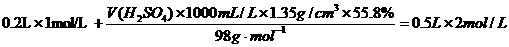 ,
, e.定容时加水量过多,用滴管吸出,导致n减小,则c偏低.
e.定容时加水量过多,用滴管吸出,导致n减小,则c偏低. ③称量、量取误差的判断方法
③称量、量取误差的判断方法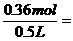 0.72mol/L.
0.72mol/L.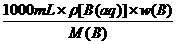
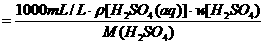
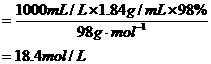
 ×100%,混合溶液中溶质的质量应是两种NaCl溶液中NaCl的质量之和,求出w/(NaCl)后,又巳知混合溶液的密度,则可求混合溶液中NaCl的物质的量浓度.
×100%,混合溶液中溶质的质量应是两种NaCl溶液中NaCl的质量之和,求出w/(NaCl)后,又巳知混合溶液的密度,则可求混合溶液中NaCl的物质的量浓度.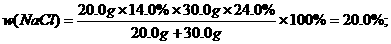
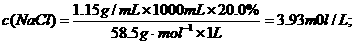
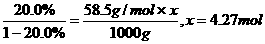 .
.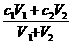 或m1·a%+m2·b%=(m1+m2)·c%.
或m1·a%+m2·b%=(m1+m2)·c%.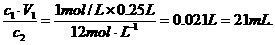
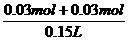 =0.40mol/L.
=0.40mol/L.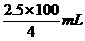 =62.5 mL.
=62.5 mL.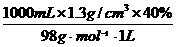 =5.31 mol/L,
=5.31 mol/L,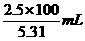 =47.1mL.
=47.1mL.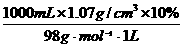 =1.09 mol/L,
=1.09 mol/L,