(一) 元素周期律
1、自主探究1:
1、电子层排列的周期性
写出1-18号元素的名称、原子结构示意图。根据原子结构示意图总结并找出规律。
|
原子序数 |
电子层数 |
最外层电子数 |
达到稳定结构时的最外层电子数 |
|
1~2 |
1 |
 1
2 1
2 |
2 |
|
3~10 |
|
|
|
|
11~18 |
|
|
|
结论: 随着核电荷数的增加发生周期性变化。
2、自主探究2:2、化合价的周期性变化
标出1-18号元素的化合价,找出规律。
|
原子序数 |
最高正价或最低负价的变化 |
|
1~2 |
+1 |
|
3~10 |
  +1
+4
+5 +1
+4
+5 -4
-1 -4
-1 |
|
11~18 |
   +1
+4
+5
+7 +1
+4
+5
+7 -4
-1 -4
-1 |
结论:随着原子序数的递增,元素 也呈现周期性变化。
3、自主探究3:3、原子半径的递变规律
|
元素符号 |
H |
|
|
|
|
|
|
He |
|
原子半径nm |
0.037 |
|
|
|
|
|
|
 |
|
元素符号 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
原子半径nm |
0.152 |
0.089 |
0.082 |
0.077 |
0.075 |
0.074 |
0.071 |
 |
|
元素符号 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
|
原子半径nm |
0.186 |
0.160 |
0.143 |
0.117 |
0.110 |
0.102 |
0.099 |
 |
总结:同一周期,随着原子序数的递增,元素原子半径逐渐 ,呈现周期性变化。
4、课堂练习:1、比较Na、S原子半径的大小。 ;
2、比较Na、O原子半径的大小。 。
5、自主学习:(二)、微粒半径大小的比较
1、原子半径大小的比较
同主族,从上到下,原子半径逐渐 。
同周期,从左到右,原子半径逐渐 。
2、离子半径大小的比较
(1)具有相同电子层结构的离子半径大小的比较
电子层数相同,随着核电荷数的增加,原子核对核外电子的吸引能力 ,半径 。
(2)同主族离子半径大小的比较
元素周期表中从上到下,电子层数逐渐 ,离子半径逐渐 。
(3)同一元素的不同离子的半径大小比较
同种元素的各种微粒,核外电子数越多,半径 ,高价阳离子半径 低价离子半径。
6、练习反馈:
1.ⅦA族元素单质的沸点( );第三周期元素的最高正化合价( );IA族元素单质熔点( );F-,Na+,Mg2+,Al3+四种离子的离子半径( );同周期短周期元素的原子半径( ).
2.按粒子的半径从小到大顺序排列的是( ) A.Cl,S,P B.N,O,F C.Al3+,Mg2+,Na+ D.K,Na,Li 3.下列各组微粒中,按微粒半径依次增大排列的是( ) (A)Al3+,Al,Na,K (B)F,Cl,S2- ,S (C)S2-,Cl - ,K + ,Ca 2+ (D)Mg,Si,P,K 4.a元素的阴离子,b元素的阴离子,c元素的阳离子具有相同的电子层结构,已知a的原子序数大于b的原子序数,则a,b,c三种离子半径大小的顺序是( ) A.a>b>c B.b>a>c C.c>a>b D.c>b>a
7、反思,谈得失:
8、课后练习:
1.有一种碘和氧的化合物可以称为碘酸碘(提示:碘酸的化学式为HIO3),其中碘元素呈+3,+5两种价态,则这种化合物的化学式为 ( ) (A) I2O4 (B) I3O5 (C) I4O7 (D) I4O9
2.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是 ( )
A.原子半径 A>B>D>C B.原子序数 d>c>b>a
C.离子半径 C>D>B>A D.原子结构的最外层电子数目 A>B>D>C
3.具有相同电子层结构的三种粒子A2+、B2-、C.下列分析正确的是 ( )
A.原子序数关系是C>B>A B.粒子半径关系是B2-<A2+
C.C一定是稀有气体元素的一种原子 D.原子半径关系是A<C<B
4.下列说法中正确的是 ( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
5.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断 ( )
A.R一定是第四周期元素 B.R一定是ⅣA族元素
C.R的气态氢化物比同族其他元素气态氢化物稳定
D.R气态氢化物化学式为H2R
6.主族元素X的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是 ( )
(A)X的原子序数比Y的小 (B)X原子的最外层电子数比Y的大
(C)X的原子半径比Y的大 (D)X元素的最高正价比Y的小
7.若短周期的两元素可形成原子个数比为2 :3的化合物,则这两种元素的序数之差不可能是 ( )
A.1 B.3 C.5 D.6
8. aXn-和bYm+为两主族元素的离子, 它们的电子层结构相同, 下列判断错误的是 ( )
A.原子半径X<Y B.a+n=b-m
C.Y最高价氧化物的化学式为YOm D.X的氢化物的化学式为HnX
9.下列微粒半径之比大于1的是
( )
A.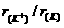 B.
B.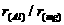 C.
C.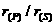 D.
D.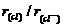
10.属于短周期的A、B两元素,A的原子半径小于B的原子半径,两元素可形成A显正价的AB2的化合物。 下列有关A、B两元素的叙述中,正确的是 ( )
A.A、B可能属于同一周期 B.A是B的前一周期元素
C.A只能是金属元素 D. A可能是第二周期中的II A族或IV A族元素
11. 有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径 ,阴离子所带的负电荷数为
,阴离子所带的负电荷数为 。则四种元素核电荷数由小到大的顺序为
( )
。则四种元素核电荷数由小到大的顺序为
( )
A.  B.
B. 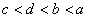 C.
C.  D.
D. 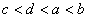
12.X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是 ( )
A. X>Y>Z B. Y>X>Z C. Z>X>Y D. Z>Y>X
13.在1~18号元素中,除稀有气体元素外:
(1)原子半径最大的元素是 ,
(2)原子半径最小的元素是 。
14.aA2+,
bB+ , cC3- , dD-具有相同的电子层结构,则它们的原子序数大小关系是__________________________________原子半径大小关系是_______________________,离子半径大小关系是____________________
15.设X、Y、Z代表三种元素。已知:(1)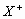 和
和 两种离子具有相同的电子层结构;(2)Z元素原子核内质子数比Y元素原子核内质子数少9个;(3)Y和Z两种元素可以形成4核(其中有1核为Y核)42电子的
两种离子具有相同的电子层结构;(2)Z元素原子核内质子数比Y元素原子核内质子数少9个;(3)Y和Z两种元素可以形成4核(其中有1核为Y核)42电子的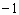 价阴离子。据此,请填空:
价阴离子。据此,请填空:
(1)Y元素是___________,Z元素是_____________。
(2)由X、Y、Z三种元素所形成的含60个电子的盐类化合物的化学式是______。

