任何一种物质的用途与其性质是分不开的.
氯气的用途和性质关系
|
氯气的用途 |
氯气的性质 |
|
漂白剂 |
Cl2与水反应生成 |
|
消毒剂 |
的HClO具有强氧化性 |
|
工业上合成盐酸 |
H2与Cl2反应生成HCl |
|
制漂白粉 |
Cl2与Ca(OH)2反应 |
|
制农药 |
Cl2与P反应生成的PCl3可用于制农药 |
|
制氯仿(CHCl3) |
Cl2与CH4反应 |
[重点难点解析]
1.氯水的成分和性质
(1)氯水的成分
氯水是氯气的水溶液,通常情况下为浅黄色溶液,氯水中只有部分Cl2与水反应,其化学方程式为:
Cl2+H2O HCl+HClO
HCl+HClO
新制的氯水中含Cl2、H2O、HClO等分子和H+、Cl-、ClO-、OH-等离子.
(2)氯水的性质
氯水具有多种物质的性质:Cl2、HClO具有强氧化性,HCl具有强酸性,HClO具有弱酸性……
氯水的性质比较复杂,有可能存在多种成分同时作用于一种物质.在一般情况下,认为是溶液中氯分子的性质.若为盐酸或次氯酸的性质,主要有下面几种情况.
①作为盐酸的性质:当与弱酸的盐或硝酸银溶液作用时,主要作为盐酸性质,例如:
氯水与Na2CO3溶液反应:
Cl2+2H2O HCl+HClO
HCl+HClO
2HCl+Na2CO3 = 2NaCl+CO2↑+2HclO
氯水与AgNO3溶液反应:
Cl2+H2O HCl+HClO
HCl+HClO
HCl+AgNO3→AgCl↓+HNO3
总方程式:Cl2+H2O+AgNO3 = AgCl↓+HClO+HNO3
注意:不是形成AgClO,因HClO是弱酸,且次氯酸的盐类溶于水,不能生成沉淀.
②作为次氯酸的性质:当氯水用于漂白(与有机化合物色素作用)、消毒、杀菌,溶液的保存和溶液酸性的变化等.利用的化学性质是强氧化性和不稳定性.
③要注意液氯与氯水的区别:液氯是纯净物,成分是Cl2分子,而氯水是混合物.
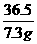 =
=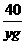 解得y=8<12
解得y=8<12

 =
=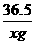 解得x=7.3
解得x=7.3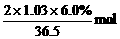
 2HCl+O2↑),故(A)、(C)选项不符合要求.
2HCl+O2↑),故(A)、(C)选项不符合要求. NaHSO4+HCl↑.根据生成HCl的质量和NaOH的质量[60×20%=12(g)]判断谁过量,即可知滴入石蕊后溶液呈什么颜色.
NaHSO4+HCl↑.根据生成HCl的质量和NaOH的质量[60×20%=12(g)]判断谁过量,即可知滴入石蕊后溶液呈什么颜色. MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O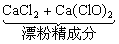 +2H2O
+2H2O