网址:http://m.1010jiajiao.com/timu3_id_153799[举报]
(12分)碱式碳酸镁密度小,是橡胶制品的优良填料。可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的含镁复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在 120℃干燥得到碱式碳酸镁产品。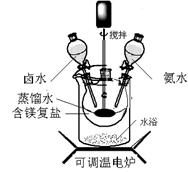
(1)①搅拌的目的是 ,②选择水浴加热方式,其优点是: 。
(2) 40℃复盐开始热解生成MgCO3·3H2O,该反应的化学方程式为: 。
(3)40℃时,开始滴加卤水的目的是
(4)碱式碳酸镁产品中镁的质量分数(ω(Mg)%)越高,产品质量越好,氯的质量分数越高,产品质量越差。分析Cl-含量采用滴定法,先精确称取一定量产品用适量硝酸溶解,经稀释等步骤最终配得一定体积的溶液。
测定实验中除用到天平、烧杯、玻璃棒、锥形瓶、滴定管外,还用到的玻璃仪器有: 。
(5)若已知制得的碱式碳酸镁的质量ag,要确定其组成(不考虑微量杂质),还必需的数据有: 。
①充分灼烧后,剩余固体的质量 ②灼烧时,测算得的二氧化碳的体积(已换算成标准状况) ③灼烧时的温度和时间 ④碱式碳酸镁的密度
(12分)碱式碳酸镁密度小,是橡胶制品的优良填料。可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的含镁复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在 120℃干燥得到碱式碳酸镁产品。
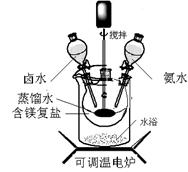
(1)①搅拌的目的是 ,②选择水浴加热方式,其优点是: 。
(2) 40℃复盐开始热解生成MgCO3·3H2O,该反应的化学方程式为: 。
(3)40℃时,开始滴加卤水的目的是
(4)碱式碳酸镁产品中镁的质量分数(ω(Mg)%)越高,产品质量越好,氯的质量分数越高,产品质量越差。分析Cl-含量采用滴定法,先精确称取一定量产品用适量硝酸溶解,经稀释等步骤最终配得一定体积的溶液。
测定实验中除用到天平、烧杯、玻璃棒、锥形瓶、滴定管外,还用到的玻璃仪器有: 。
(5)若已知制得的碱式碳酸镁的质量ag,要确定其组成(不考虑微量杂质),还必需的数据有: 。
①充分灼烧后,剩余固体的质量 ②灼烧时,测算得的二氧化碳的体积(已换算成标准状况) ③灼烧时的温度和时间 ④碱式碳酸镁的密度
查看习题详情和答案>>
某天然碱的化学组成可能为aNa2CO3?bNaHCO3?cH2O (a、b、c为正整数),
为确定其组成,化学兴趣小组的同学进行了如下实验:
(1)定性分析:
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。
②请你设计一个简单的实验方案,确认样品中含有CO32―离子。
(2)定量分析:该小组同学设计了下图所示装置,测定天然碱的化学组成。
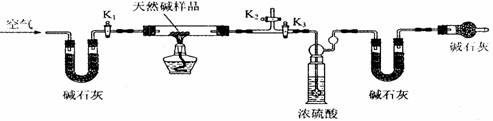
A B C D E
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 。
A处碱石灰的作用是 E处碱石灰的作用是
。
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为87.6g,装碱石灰的U型管D的质量为74.7g。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后称得装浓硫酸的洗气瓶质量为88.5g;装碱石灰的U型管D的质量为75.8g。该步骤中缓缓鼓入空气数分钟的目的是
。计算推导:该天然碱的化学式为 。
查看习题详情和答案>>(1)可用改进汽油组成的办法来改善汽油的燃烧性能.例如,加入![]() 来生产“无铅汽油”.
来生产“无铅汽油”.![]() 分子中必存在的原子间连接形式有________(填写编号,多选倒扣).
分子中必存在的原子间连接形式有________(填写编号,多选倒扣).
![]()
![]() .
.
(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一,天然气常和石油伴生,其主要的成分是________.能说明它是正四面体而非正方形平面结构的理由是________(填写编号,多选倒扣).
①其一氯取代物不存在同分异构体;
②其二氯取代物不存在同分异构体;
③它是非极性分子;
④它的键长和键角都相等.
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50公里/小时行驶了40公里.为了有效发展民用氢能源,首先必须制得廉价的氢气.下列可供开发又较经济的制氢方法是________(填写编号,多选倒扣).
①电解水;②锌和稀硫酸反应;③光解海水.
其次,制得纯氢气后还需要解决的问题是________(写出其中一个).
查看习题详情和答案>>
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH.
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)500℃时,
在体积为1 L的容积固定的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=________mol·L-1·min-1.
②该反应的平衡常数K=________(保留一位小数),平衡时H2的转化率为________.
③已知温度升高,K值减小.下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
(2)CH3OH作为内燃机燃料或通过燃料电池驱动车辆.可减少CO2排放多达45%.
①已知:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
则反应
CH3OH(g)+②
甲醇质子交换膜燃料电池的结构示意图如下,已知H+移向通入O2的电极,甲醇进入________极(填“正”或“负”),正极发生的电极反应为________.