网址:http://m.1010jiajiao.com/timu3_id_153796[举报]
A.白烟 B.白雾 C.白色烟雾 D.棕黄色烟 E.棕黄色烟雾
①灼热的铜丝在氯气中燃烧,集气瓶内产生( );
②氢气在氯气中燃烧,集气瓶口有( );
③红磷在氯气中燃烧,集气瓶内产生大量的( );
④金属钠在氯气中燃烧,集气瓶口产生大量的( )。
(2)指出下列诗词名句中所出现的“烟”字,哪些指的是真正的“烟”?( )
A.大漠孤烟直,长河落日圆
B.暧暧远人村,依依墟里烟
C.南朝四百八十寺,多少楼台烟雨中
D.谈笑间,樯橹灰飞烟灭
E.碧云天,黄叶地;秋色连波,波上寒烟翠
F.一川烟草,满城风絮,梅子黄时雨
铁和铝是两种重要的常见金属.请回答:
(1)将烧得红热的铁丝伸入盛有氯气的集气瓶中,可观察到有棕黄色的烟生成.
该反应的化学方程式为________.
(2)常温下,将铁、铝放入浓硝酸中,可发生钝化现象,是由于浓硝酸具有________.
(3)红热的铁高温下与水蒸气反应的方程式是________.

(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过.图乙、图丙是一个将
(3)从上述现象中可以归纳出构成原电池的一些条件是
| A、钠可以在氯气中燃烧,产生白色的烟 | B、红热的铜丝可以在氯气中燃烧,产生紫红色的烟 | C、纯净的氢气可以在氯气中安静的燃烧,发出苍白色火焰 | D、氯气作用于干燥的品红试纸,试纸不褪色 |
化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热)。
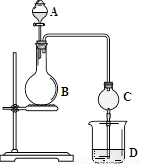
(1)若A中为浓盐酸,B中为高锰酸钾固体,D中为石蕊溶液,则D中现象为________________________。
(2)若A中为足量的浓硝酸,B中为铜单质,D中用NaOH来吸收其产生的气体,请写出D中所发生的反应的化学方程式________________________________________________。
(3)若A中为浓H2SO4,B中为NaCl固体, D中是Na2S与Na2SO3的混合溶液,打开分液漏斗后,加热,D中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则D中n(Na2S)与n(Na2SO3)需满足的条件是______________________________。
(4)该装置可以模拟氨碱法制纯碱,D中为饱和食盐水。先制取________气体通入D中至饱和,再制取_______气体也通入D中,此时可以看到溶液中有晶体析出。请写出该反应的化学方程式___________________________________________________。
(5)利用上述装置,下列实验不可能实现的是_____________________
A.证明碳酸比苯酚的酸性强 B.证明氯气的氧化性比溴强
C.用乙醇制备并检验乙烯 D.制备并收集乙酸乙酯
(6)若A中为稀硫酸,B中为碳酸氢钠固体,打开分液漏斗反应一段时间,D中先无现象,后慢慢产生沉淀且不溶解,则D溶液的原溶质可能是______________________________。
查看习题详情和答案>>