3、Fe2+和Fe3+鉴别
|
|
Fe2+ |
Fe3+ |
|
水溶液颜色 |
浅绿 |
棕黄 |
|
加入NaOH |
Fe2++2OH-==Fe(OH)2↓ 4Fe(OH)2+O2+2H2O==4Fe(OH)3 白 →灰绿 → 红褐色 |
Fe3++3OH-==Fe(OH)3↓ (红褐色) |
|
加入KSCN |
Fe2++2SCN-=Fe(SCN)2 无色 |
Fe3++3SCN-=Fe(SCN)3 血红色 |
|
通入Cl2 |
2Fe2++Cl2=2Fe3++2Cl- |
|
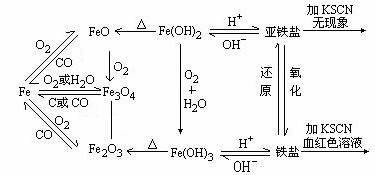
2.关于Fe元素的两种氢氧化物
|
|
Fe(OH)2 |
Fe(OH)3 |
|
|
颜色 |
白 →灰绿 → 红褐色 |
||
|
化学性质 |
①
4Fe(OH)2+O2+6H2O= 4Fe(OH)3 (不稳定) (较稳定) |
||
|
②Fe(OH)2+2H+=Fe2++2H2O |
Fe(OH)3+3H+=Fe3++3H2O |
||
思考:用可溶性碱分别与Fe2+、Fe3+反应可制得Fe(OH)2和Fe(OH)3。实际操作时有何不?通过哪些方法可避免生成Fe(OH)2中会有Fe(OH)3?
提示:关键在于无孔不入的O2及Fe3+存在。
①驱氧法:如用同煮沸过的NaOH溶液
②隔氧法:如用长滴管吸取NaOH溶液后插入亚铁盐溶液面下加入;又如在液面上加某些合适的有机溶剂液封。
③还原法:在FeSO4溶液中加入Fe钉,或者用Fe与稀H2SO4反应新制的FeSO4溶液,生成的H2又可驱赶O2.
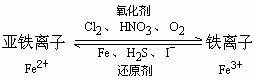
 NH3·H2O
NH3·H2O  NH4+, NH4+的量并不减少。如果不“搅拌”或隔绝空气的条件下:Fe2+
NH4+, NH4+的量并不减少。如果不“搅拌”或隔绝空气的条件下:Fe2+  NH3↑,Fe(OH)2
NH3↑,Fe(OH)2  Fe(OH)3
Fe(OH)3