摘要:2.关于Fe元素的两种氢氧化物 Fe(OH)2 Fe(OH)3 颜色 白 →灰绿 → 红褐色 化学性质 ① 4Fe(OH)2+O2+6H2O= 4Fe(OH)3 ②Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O 思考:用可溶性碱分别与Fe2+.Fe3+反应可制得Fe(OH)2和Fe(OH)3.实际操作时有何不?通过哪些方法可避免生成Fe(OH)2中会有Fe(OH)3? 提示:关键在于无孔不入的O2及Fe3+存在. ①驱氧法:如用同煮沸过的NaOH溶液 ②隔氧法:如用长滴管吸取NaOH溶液后插入亚铁盐溶液面下加入,又如在液面上加某些合适的有机溶剂液封. ③还原法:在FeSO4溶液中加入Fe钉.或者用Fe与稀H2SO4反应新制的FeSO4溶液.生成的H2又可驱赶O2.
网址:http://m.1010jiajiao.com/timu_id_3995831[举报]
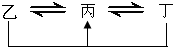 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:(1)写出化合物甲的电子式:


(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
;写出均含有F元素的乙与丁在溶液中发生反应的离子方程式Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.(3)由A、C元素组成的化合物戊和A、E元素组成的化合物己,式量均为34.其中戊的熔沸点高于己,其原因是:
H2O2分子间存在氢键
H2O2分子间存在氢键
.(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐.请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
.该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体.写出相关反应的化学方程式(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
,析出该复盐晶体的原理是硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
.
稀土元素是周期表中IIIB族钪、钇和锏系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
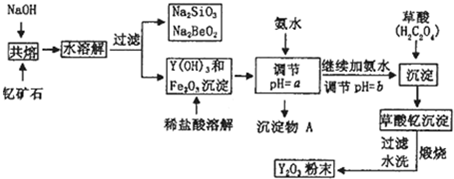
已知:①常温下KSP=[Fe(OH)3]=4×10-38,lg2≈0.3 ②有关金属离子形成氢氧化物沉淀时的pH如下表:
③在周期表中、铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为 .
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、 (填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液b.氨水c.CO2气d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式: .
(3)一般认为离子浓度小于1×10-5mol?L-1为沉淀完全,试计算Fe3+完全沉淀时x= ,实际操作要大于x,为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在 的范围内;检验Fe3+是否沉淀完全的操作方法是 .
查看习题详情和答案>>

已知:①常温下KSP=[Fe(OH)3]=4×10-38,lg2≈0.3 ②有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | x |
| Y3+ | 6.0 | 8.2 |
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、
a.NaOH溶液b.氨水c.CO2气d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:
(3)一般认为离子浓度小于1×10-5mol?L-1为沉淀完全,试计算Fe3+完全沉淀时x=
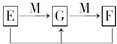 已知A、B、C、D两种短周期元素,分别属于不同的主族,其原子序数依次增大,其中A与D、B与C的原子的最外层电子数之和均为9,A原子的最外层与次外层电子数相等,A、B、C、D中只有两种金属元素.试回答下列问题:
已知A、B、C、D两种短周期元素,分别属于不同的主族,其原子序数依次增大,其中A与D、B与C的原子的最外层电子数之和均为9,A原子的最外层与次外层电子数相等,A、B、C、D中只有两种金属元素.试回答下列问题:(1)A的元素符号为
Be
Be
,C的氢化物的化学式为H2S
H2S
.(2)为比较C与D的单质的氧化性强弱,可设计实验以证实,则该实验所依据的反应的化学方程式为
Fe+S
FeS,2Fe+3Cl2
2FeCl3(或H2S+Cl2═S↓+2HCl)
| ||
| ||
Fe+S
FeS,2Fe+3Cl2
2FeCl3(或H2S+Cl2═S↓+2HCl)
.
| ||
| ||
(3)1molC的氢化物与足量C的氧化物反应,转移的电子的物质的量为
2
2
mol.(4)已知E、G、F是均含有B元素的化合物,其有关转化关系如图,请写出E与F反应生成G的离子方程式
Al3++3AlO2-+6H2O═4Al(OH)3
Al3++3AlO2-+6H2O═4Al(OH)3
.A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系知图所示.

请回答下列问题:
(1)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,则B的化学式可能为
(2)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,则A的电子式为
 ,B的结构式为
,B的结构式为
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂.
①25℃时,pH均为10的A、B两溶液中,由水电离出的氢氧根离子浓度之比为
②25℃时,0.1mol?L-1的A、B、C三种溶液,分别用水稀释不同的倍数后,溶液的pH相同,则稀释后溶液的物质的量浓度最大的是
③将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小顺序为
查看习题详情和答案>>

请回答下列问题:
(1)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,则B的化学式可能为
FeCl3或Fe(NO3)3
FeCl3或Fe(NO3)3
.(写出一种即可)(2)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,则A的电子式为


N≡N
N≡N
.(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂.
①25℃时,pH均为10的A、B两溶液中,由水电离出的氢氧根离子浓度之比为
10-6:1或1:106
10-6:1或1:106
②25℃时,0.1mol?L-1的A、B、C三种溶液,分别用水稀释不同的倍数后,溶液的pH相同,则稀释后溶液的物质的量浓度最大的是
NaHCO3
NaHCO3
溶液(填溶质的化学式).③将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.(2012?闵行区二模)在下列物质转化关系中,反应的条件和部分产物已略去.已知:甲、乙是两种常见金属,反应Ⅲ是工业制备盐酸的反应.

回答下列问题:
(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则该黄色物质的电子式为
 ,该化合物中存在的化学键有
,该化合物中存在的化学键有
与甲在同一周期的金属元素(包括甲),按单质熔点由高到低的顺序排列依次为
(2)反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙在周期表中的位置是
(3)通过比较反应I、II的反应条件,可得出甲的金属性比乙的金属性
(4)下列关于第三周期金属元素的单质及其化合物的说法正确的是
a.工业上一般用电解法进行冶炼,获取单质
b.金属阳离子都具有相同的电子排布式
c.氢氧化物都很容易分解得到相应的氧化物
d.金属氯化物都是电解质,都属于离子化合物.
查看习题详情和答案>>

回答下列问题:
(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则该黄色物质的电子式为


离子键、极性键
离子键、极性键
.与甲在同一周期的金属元素(包括甲),按单质熔点由高到低的顺序排列依次为
Al>Mg>Na
Al>Mg>Na
(用元素符号表示).(2)反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙在周期表中的位置是
第四周期第Ⅷ族
第四周期第Ⅷ族
;反应II的化学方程式为3Fe+4H2O(g)
Fe3O4+4H2(g)
| ||
3Fe+4H2O(g)
Fe3O4+4H2(g)
.
| ||
(3)通过比较反应I、II的反应条件,可得出甲的金属性比乙的金属性
强
强
(填“强”或“弱”),比较二者金属性强弱的依据是NaOH是强碱而Fe(OH)3是弱碱
NaOH是强碱而Fe(OH)3是弱碱
(写出一种即可).(4)下列关于第三周期金属元素的单质及其化合物的说法正确的是
ab
ab
(选填答案编号).a.工业上一般用电解法进行冶炼,获取单质
b.金属阳离子都具有相同的电子排布式
c.氢氧化物都很容易分解得到相应的氧化物
d.金属氯化物都是电解质,都属于离子化合物.